题目内容
Fe2O3、CuO的混合粉末3.20g,高温下与足量H2充分反应后,得到固体的质量可能为
- A.2.24g
- B.2.40g
- C.2.56g
- D.4.00g
B
分析:我们可以用极限法,假设混合粉末全是Fe2O3,可计算出得到的铁质量;然后又假设粉末全为CuO,可计算出得到的铜的质量,所以得到固体的质量应在计算所得的铁的质量和铜的质量之间.
解答:假设混合粉末全是Fe2O3用氢气还原可得铁的质量是x
Fe2O3+3H2 2Fe+3H2O
2Fe+3H2O
160 112
3.2g x
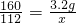
x=2.24g
假设混合粉末全是CuO用氢气还原可得铜的质量是y
CuO+H2 Cu+H2O
Cu+H2O
80 64
3.2g y
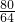 =
=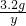
y=2.56g
所以与足量的H2反应后得到的固体质量只会介于2.24g和2.56g之间,观察选项B符合;
故选B
点评:此题是一道典型的极端假设法求解的问题,解题的关键是掌握极限假设法(即假设两头)的具体使用方法;
分析:我们可以用极限法,假设混合粉末全是Fe2O3,可计算出得到的铁质量;然后又假设粉末全为CuO,可计算出得到的铜的质量,所以得到固体的质量应在计算所得的铁的质量和铜的质量之间.
解答:假设混合粉末全是Fe2O3用氢气还原可得铁的质量是x
Fe2O3+3H2
 2Fe+3H2O
2Fe+3H2O160 112
3.2g x
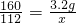
x=2.24g
假设混合粉末全是CuO用氢气还原可得铜的质量是y
CuO+H2
 Cu+H2O
Cu+H2O80 64
3.2g y
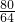 =
=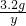
y=2.56g
所以与足量的H2反应后得到的固体质量只会介于2.24g和2.56g之间,观察选项B符合;
故选B
点评:此题是一道典型的极端假设法求解的问题,解题的关键是掌握极限假设法(即假设两头)的具体使用方法;

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 以下甲、乙两题任选做一题,若两题都做,以甲题记分.
以下甲、乙两题任选做一题,若两题都做,以甲题记分.甲题:现有16g Fe2O3和CuO的混合物,进行如下实验;把混合物全部加入到100 g 足量的硫酸溶液中,完全溶解.然后滴加150g 16%的氢氧化钠溶液,沉淀质量不再改变.试计算所用硫酸溶液溶质的质量分数.
乙题:某固态混合物中含有m g KNO3和若干克不溶于水的杂质,将此混合物加入n g水中,在10℃,40℃,75℃时观察,充分溶解后的结果如表所示.KNO3的溶解度曲线见图.
| 温度(℃) | 10 | 40 | 75 |
| 未溶固体质量(g) | 261 | 175 | 82 |
(1)m、n的值各为多少?
(2)75℃时所得KNO3溶液是否饱和?
(3)若要在n g水中恰好溶解m g 硝酸钾即饱和,则温度应控制在多少度?
