题目内容
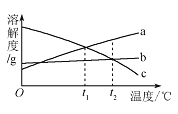
【题目】如图是a.b、c三种物质的溶解度曲线,下列有关说法不正确的是( )
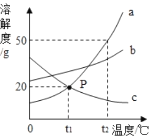
A.t1℃时,将30g的a加入100g水中,可得到120g溶液
B.P点表示t1℃时a和c的溶液的溶质质量分数相等
C.t2℃时,溶解等量的a、b、c三种物质,需要水的质量顺序为:a<b<c
D.将t1℃时a、b、c的饱和溶液分别升温到t2℃,所得溶液中溶质的质量分数大小顺序为:b>a>c
【答案】B
【解析】
A、t1℃时,物质a的溶解度是20g,表述的含义是:t1℃时,在100g的水中,物质a达到饱和状态时可以溶解20g。所以当加入30g物质a时,溶液达到过饱和状态,此时溶液的质量为:20g+100g=120g。故A说法正确;
B、P点是物质a和物质c的溶解度曲线的交点,表示的含义是在t1℃时,物质a和物质c的溶解度相等,均为20g。由于没有确定溶液是否饱和,不能确定溶液溶质质量分数是否相等。故B说法错误;
C、t2℃时,三种物质的溶解度大小为a>b>c。根据溶解度涵义,当三种物质质量相等时,需要水的质量相反,为c>b>a。故C说法正确;
D、将t1℃时的a、b、c三种物质的饱和溶液升温到t2℃时,a、b转化为不饱和溶液,没有溶质析出,c依然是饱和溶液。但是c的溶解度随温度的升高而降低,C有溶质析出,故t2℃时,c的溶质质量分数最小。因为t1℃时,b的溶解度大于a,升温后,溶质的质量分数不变,所以在升温后b的溶质质量分数大于a。所以质量分数的顺序是b>a>c。故D说法正确。
故选B。

【题目】小明在课外阅读中得知:氢氧化铜受热会分解生成氧化铜(Ca(OH)2=CuO+X),于是用CuSO4溶液与KOH溶液反应制取氢氧化铜,并对氢氧化铜进行加热。
(1)生成物X的化学式为____。
(2)制取氢氧化铜的化学方程式为____。
(3)小明在加热氢氧化铜时,发现蓝色固体先变成黑色;继续高温灼烧黑色固体变成红色,同时有气体产生。为弄清这种红色固体的成份,进行了如下的探究:
(查阅资料)Cu和Cu2O均为红色固体,且Cu2O+H2SO4=Cu+CuSO4+H2O。
(提出猜想)红色固体是:Ⅰ.Cu;Ⅱ.Cu2O;Ⅲ.①____。
操作 | 现象 | 结论 |
①取灼烧后的红色固体1.44g于试管中,加入足量稀硫酸,加热并充分震荡,静置。 | 溶液由无色变蓝色,固体减少。 | 1.44g红色固体一定有:②____。 |
②过滤、洗涤、干燥。 | 得红色固体 |
(进行实验)
(结论分析)
③据上述实验现象,小明认为猜想Ⅲ正确。但有同学认为小明的判断不严谨,因为猜想___也有相同的现象。
④为了进一步确定1.44g红色固体的成分,同学们将充分反应的固体过滤、洗涤、干燥后称重为1.24g,通过计算后确定猜想Ⅲ正确,请你计算出1.44g红色固体中Cu为____g、Cu2O为______g。
【题目】实验室常用加热氯酸钾与二氧化锰混合物的方法制取氧气,写出反应的文字表达式:__________________________
小芳发现,氯酸钾与氧化铜混合加热,也能较快产生氧气,于是进行如下探究:
(提出猜想)除二氧化锰、氧化铜外,氧化铁也可以作氯酸钾分解的催化剂。
(完成实验)按下表进行实验:并测定分解温度(分解温度越低,催化效果越好)。
实验编号 | 实验药品 | 分解温度(℃) |
① | 氯酸钾 | 580 |
② | 氯酸钾、二氧化锰(质量比1:1) | 350 |
③ | 氯酸钾、氧化铜(质量比l:1) | 370 |
④ | 氯酸钾、氧化铁(质量比1:1) | 390 |
(分析数据、得出结论)(1)由实验____________与实验④对比,证明猜想合理。
(2)实验所用的三种金属氧化物,催化效果最好的是_____________________。
(反思)(1)若要证明氧化铁是该反应的催化剂,还要验证它在化学反应前后质量和__________不变;
(2)同种催化剂,颗粒大小可能影响催化效果,请设计实验方案进行验证_______________________。
(3)同种催化剂,还有哪些因素可能影响催化效果,请你再探究 (探究一种因素即可)____。