题目内容
查阅资料:草酸在浓硫酸存在时加热发生如下反应:
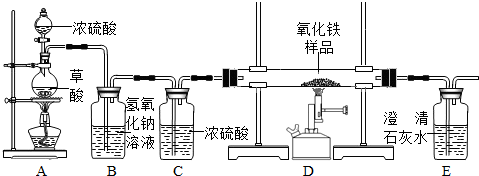
H2C2O4 CO↑+CO2↑+H2O.某化学课题组的同学欲用如下装置完成如下实验任务:
CO↑+CO2↑+H2O.某化学课题组的同学欲用如下装置完成如下实验任务:
①用干燥纯净的CO气体还原不纯的氧化铁试样(其中的杂质不发生变化);
②实验CO气体还原氧化铁生成的气体生成物的性质.
请回答下列问题:
(1)装置C的作用是______;
(2)装置D中发生反应的化学方程式为______;
(3)装置E中出现的现象是______;
(4)从环境保护角度分析,此装置存在的明显不足是______;
(5)小明利用此装置测定了该氧化铁样品中氧化铁的质量分数,方法是:称量氧化铁样品的质量10.0 g,玻璃管的质量为
50.0 g,完全反应并冷却后再称量玻璃管与剩余固体的总质量为57.6 g.则样品中氧化铁的质量分数为______.
解:(1)装置C中所盛放浓硫酸具有吸水性,故答案为:干燥气体或吸收水蒸气
(2)高炉炼铁的原理:3CO+Fe2O3 2Fe+3CO2
2Fe+3CO2
(3)二氧化碳与氢氧化钙反应生成不溶于水的白色沉淀碳酸钙,故答案为:澄清石灰水变浑浊
(4)一氧化碳有毒,过程中可能一氧化碳过多,必须对尾气进行处理.故答案为:没有尾气处理装置
(5)原有样品为氧化铁(10g),反应后为剩余固体为(7.6g),减少的质量为2.4g,实质为氧元素的质量,运用差量法解题
设氧化铁的质量为X
3CO+Fe2O3 2Fe+3CO2 固体质量差量
2Fe+3CO2 固体质量差量
160 112 48
X (10-7.6)g
160:48=X:(10-7.6)g
X=8g
氧化铁的质量分数为:8g÷10.0g×100%=80%
故答案为:80%
分析:本题是在原有一氧化碳还原氧化铁的实验基础上增加了制取纯净的一氧化碳的实验,由题中信息,草酸分解后得到的一氧化碳中混有二氧化碳和水蒸气,因此要预先除尽.氢氧化钠与二氧化碳反应消耗,浓硫酸具有吸水性除去水分.产生的二氧化碳使澄清石灰水变浑浊,过程中可能一氧化碳过多,必须对尾气进行处理.(5)中氧化铁还原为铁,质量减轻,运用差量法可求出氧化铁的质量,再利用质量分数公式求算.
点评:本题考查了高炉炼铁的原理、实验现象、尾气处理以及应用.
(2)高炉炼铁的原理:3CO+Fe2O3
 2Fe+3CO2
2Fe+3CO2(3)二氧化碳与氢氧化钙反应生成不溶于水的白色沉淀碳酸钙,故答案为:澄清石灰水变浑浊
(4)一氧化碳有毒,过程中可能一氧化碳过多,必须对尾气进行处理.故答案为:没有尾气处理装置
(5)原有样品为氧化铁(10g),反应后为剩余固体为(7.6g),减少的质量为2.4g,实质为氧元素的质量,运用差量法解题
设氧化铁的质量为X
3CO+Fe2O3
 2Fe+3CO2 固体质量差量
2Fe+3CO2 固体质量差量160 112 48
X (10-7.6)g
160:48=X:(10-7.6)g
X=8g
氧化铁的质量分数为:8g÷10.0g×100%=80%
故答案为:80%
分析:本题是在原有一氧化碳还原氧化铁的实验基础上增加了制取纯净的一氧化碳的实验,由题中信息,草酸分解后得到的一氧化碳中混有二氧化碳和水蒸气,因此要预先除尽.氢氧化钠与二氧化碳反应消耗,浓硫酸具有吸水性除去水分.产生的二氧化碳使澄清石灰水变浑浊,过程中可能一氧化碳过多,必须对尾气进行处理.(5)中氧化铁还原为铁,质量减轻,运用差量法可求出氧化铁的质量,再利用质量分数公式求算.
点评:本题考查了高炉炼铁的原理、实验现象、尾气处理以及应用.

练习册系列答案
 习题精选系列答案
习题精选系列答案
相关题目
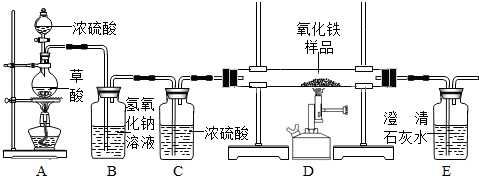
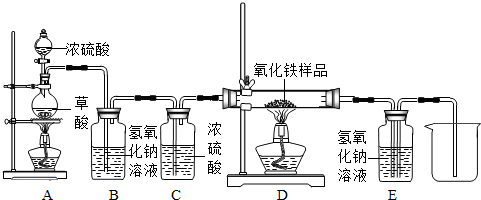

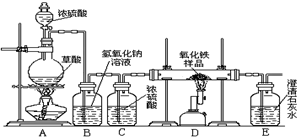 化学小组的同学在研究性学习课上展示了一套如图所示的实验装置(假设每步化学反应都完全,氧化铁样品中的杂质不参加反应,且杂质中不含铁).查阅资料:草酸在浓硫酸存在时加热发生如下反应:
化学小组的同学在研究性学习课上展示了一套如图所示的实验装置(假设每步化学反应都完全,氧化铁样品中的杂质不参加反应,且杂质中不含铁).查阅资料:草酸在浓硫酸存在时加热发生如下反应: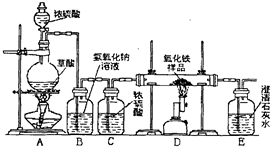 某校化学课外兴趣小组的同学在研究性学习课展示了一套如图所示的实验装置(假设每步化学反应都完全,氧化铁样品中的杂质不反应).查阅资料:草酸在浓硫酸存在时加热发生如下反应:
某校化学课外兴趣小组的同学在研究性学习课展示了一套如图所示的实验装置(假设每步化学反应都完全,氧化铁样品中的杂质不反应).查阅资料:草酸在浓硫酸存在时加热发生如下反应: