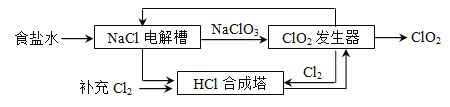
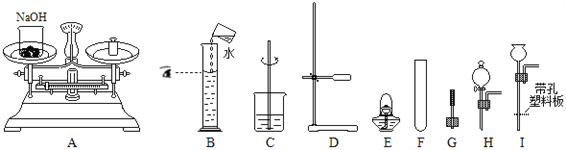
题目内容
【题目】根据下图回答问题。

(1)写出一个实验室制氧气的化学方程式,并选择相应的发生装置。
① 化学方程式:________。
② 发生装置:________。
(2)实验室收集二氧化碳用装置C而最好不用装置D的原因是________。
(3)木炭在氧气中燃烧的实验现象是________。
【答案】 2KMnO4 ![]() K2MnO4 + MnO2 + O2↑或2KClO3
K2MnO4 + MnO2 + O2↑或2KClO3![]() 2KCl + 3O2↑或2H2O2
2KCl + 3O2↑或2H2O2 ![]() 2H2O + O2↑ A 或 A 或 B 二氧化碳密度比空气大,且不与空气中的物质反应,因此可以用装置C收集,而二氧化碳能溶于水,因此最好不用装置D收集 木炭剧烈燃烧、发出白光、放出热量(剧烈燃烧、放出热量答出一点即可)
2H2O + O2↑ A 或 A 或 B 二氧化碳密度比空气大,且不与空气中的物质反应,因此可以用装置C收集,而二氧化碳能溶于水,因此最好不用装置D收集 木炭剧烈燃烧、发出白光、放出热量(剧烈燃烧、放出热量答出一点即可)
【解析】(1)根据实验室制取氧气的原理解答;
(2)根据二氧化碳易溶于水解答;
(3)根据木炭与氧气反应剧烈燃烧、发出白光、放出热量分析。
解:(1)①加入高锰酸钾:2KMnO4 △K2MnO4 + MnO2 + O2↑,发生装置:A;
②加热氯酸钾与二氧化锰的混合物:2KClO3![]() 2KCl + 3O2↑,发生装置:A;③分解过氧化氢:2H2O2
2KCl + 3O2↑,发生装置:A;③分解过氧化氢:2H2O2 ![]() 2H2O + O2↑,发生装置:B。
2H2O + O2↑,发生装置:B。
(2)由于二氧化碳密度比空气大且不与空气中的物质反应,能溶于水。故实验室收集二氧化碳用装置C而最好不用装置D的原因是二氧化碳密度比空气大,且不与空气中的物质反应,因此可以用装置C收集,而二氧化碳能溶于水,因此最好不用装置D收集;
(3)木炭在氧气中燃烧的实验现象是木炭剧烈燃烧、发出白光、放出热量(剧烈燃烧、放出热量答出一点即可)。

【题目】利用图1装置进行I、II两组实验,将滴管a中的液体滴入b中,待充分作用后,打开止水夹d。a、b、c中所加试剂如下表所示。
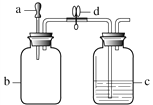
图1
实验 | a中试剂 | b中试剂 | c中试剂 |
I | 5%H2O2溶液 | MnO2 | 80 ℃热水 |
II | 石蕊溶液 | HCl气体 | NaOH溶液 |
已知:HCl气体极易溶解于水。白磷的着火点为40 ℃。
(1)实验I中,若在c中长导管口处放置一块白磷,当打开止水夹后,可观察到白磷燃烧,通过此实验能证明燃烧的条件是________。 若要证明燃烧的另一条件,在对比实验中,需将c中盛放的试剂改为________。
(2)实验II能证明NaOH与HCl发生了反应。实验过程中,打开止水夹d后,可观察到的现象为________。
(3)若按图2所示连接装置,进行实验II,则会观察到c中长导管口有气泡产生,原因是________。

图2