题目内容
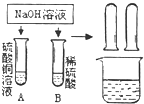
【题目】某化学小组在探究碱的化学性质时,做了如图所示的两个实验.
(1)写出A试管中发生反应的化学方程式 .
(2)实验结束后,同学们将A、B两试管中的废液倒入同一洁净的烧杯,烧杯中出现蓝色沉淀.小组同学将烧杯中的物质进行了过滤,对滤液中成分有如下猜想:
【提出猜想】甲:滤液中的溶质是Na2SO4 CuSO4
乙:滤液中的溶质是Na2SO4 H2SO4
丙:滤液中的溶质是 4
丁:滤液中的溶质是Na2SO4
【交流讨论】同学们对以上的猜想提出质疑,认为猜想 不合理,理由是
【设计实验】同学们通过以下的实验对猜想进行验证,请你完成实验报告.
实验内容 | 预计现象 | 预计结论 |
(1)取少量滤液于试管中,观察 | 溶液呈无色 | 猜想 不成立 |
(2)继续在上述试管中加入 | 产生蓝色沉淀 | 猜想 成立 |
【答案】 (1)2NaOH+CuSO4═Cu(OH)2↓+Na2SO4.(2)NaOH、Na2SO4.乙;如果滤液中含有稀硫酸,则不可能出现蓝色沉淀.【设计实验】(1)甲.(2) 硫酸铜溶液;产生蓝色沉淀;丙.
【解析】
试题分析:(1)A试管中发生反应的化学方程式为:2NaOH+CuSO4═Cu(OH)2↓+Na2SO4.(2)【提出猜想】
如果氢氧化钠过量,则滤液中的溶质是氢氧化钠和硫酸钠.【交流讨论】猜想乙不合理,理由是如果滤液中含有稀硫酸,则不可能出现蓝色沉淀.【设计实验】(1)取少量滤液于试管中,观察,溶液呈无色,说明溶液在不含有硫酸铜,猜想甲不成立.(2)继续在上述试管中加入硫酸铜溶液,产生蓝色沉淀,说明溶液中存在氢氧化钠,猜想丙成立.

练习册系列答案
相关题目