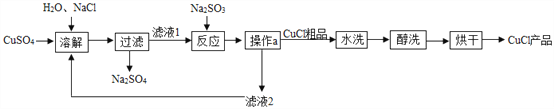
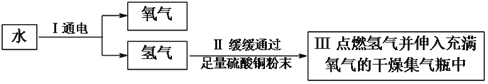题目内容
【题目】请回答下列相关问题:
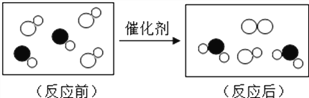
(1)稀释浓硫酸时,先往烧杯中倾倒的液体为___________。
(2)石灰石煅烧时发生反应的化学方程式为____________。
(3)打开盛有浓盐酸的瓶盖,瓶口上方看到的“白雾”是因为浓盐酸具有____________性。
【答案】 水 CaCO3 ![]() CaO +CO2↑ 挥发
CaO +CO2↑ 挥发
【解析】(1)浓硫酸的密度比水大,且浓硫酸溶于水要放出大量的热,故稀释浓硫酸时,先往烧杯中倾倒的液体为水;(2)石灰石煅烧生成氧化钙和二氧化碳气体,发生反应的化学方程式为:CaCO3![]() CaO +CO2↑;(3)浓盐酸具有挥发性,挥发出的氯化氢气体,与空气中的水蒸气结合形成盐酸小液滴,出现白雾,所以瓶口出现的白雾是盐酸小液滴。
CaO +CO2↑;(3)浓盐酸具有挥发性,挥发出的氯化氢气体,与空气中的水蒸气结合形成盐酸小液滴,出现白雾,所以瓶口出现的白雾是盐酸小液滴。

练习册系列答案
相关题目
【题目】下表是NaCl和KNO3在不同温度时的溶解度,回答问题。
温度/℃ | 10 | 20 | 30 | 40 | 50 | 60 | |
溶解度/g | NaCl | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 |
KNO3 | 20.9 | 31.6 | 45.8 | 63.9 | 85.5 | 110.0 | |
(1)两种物质中,溶解度受温度影响变化较大的是_________。
(2)60℃时,按图示操作:
![]()
A中溶质是_____(填“饱和”或“不饱和”)溶液,C中溶液的总质量是______g。
(3)50℃时,将两种物质的饱和溶液各100g,分别加热蒸发10g水后,再恢复到50℃,剩余溶液的质量:NaCl溶液_____(填“大于”“等于”或“小于”) KNO3溶液。