题目内容
【题目】(6分)酸、碱、盐在生活中应用广泛。请根据图示回答相关问题:
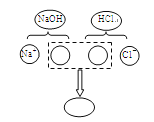
(1)从微观角度看物质的变化是化学的思维方式之一。下图表示生成氯化钠的化学反应,该反应的化学方程式是 ,其微观实质是 。
(2)对比学习有利于发现事物的共性与个性。为探究酸的化学性质,某同学进行了如下实验。
实验内容 |
|
|
|
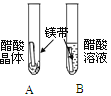
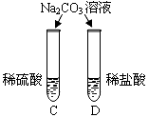
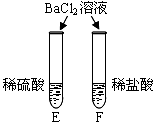
实验现象 | A试管内无明显现象,B试管中镁带表面观察到的现象是 。 | C、D两试管中均观察到有气泡产生。 | E试管中观察到的现象是 产生白色沉淀; F试管中无明显现象。 |
结论 | 酸的很多反应通常在水溶液中才能完成。 | 不同的酸根会导致酸的“个性”有差异。 |
请分析上述现象并回答:
清洗试管时,将C、F两试管中的无色液体同时倒入一个洁净的废液缸,废液缸中立刻冒气泡并出现白色沉淀。废液缸里最终产生的白色沉淀中一定含有硫酸钡,该反应的化学方程式为 ,白色沉淀中可能还含有 (填化学式)。
【答案】(1)①NaOH+HCl=NaCl+H2O;OH-与H+结合生成 H2O分子
(2)实验现象:有气泡产生或冒气泡;
实验结论:酸具有相似的化学性质或酸能与碳酸盐反应生成CO2
Na2SO4+BaCl2=2NaCl +BaSO4↓;BaCO3
【解析】
试题分析:(1)氢氧化钠与盐酸发生的是中和反应,生成的是氯化钠和水,中和反应的实质是酸中的氢离子与碱中的氢氧根离子结合生成水的过程;
(2)金属会镁反应会生成氢气,现象是产生大量的气泡;稀盐酸、稀硫酸与碳酸钠反应均会产生大量的气泡,说明酸具有相似的化学性质;
C试管中一定含有硫酸钠,F中含有氯化钡和盐酸,硫酸钠和氯化钡会反应生成氯化钠和硫酸钡沉淀:Na2SO4+BaCl2=2NaCl +BaSO4↓;由于C试管中碳酸钠不确定是否过量,如果碳酸钠过量,碳酸钠与氯化钡会反应生成碳酸钡沉淀。

练习册系列答案
相关题目