题目内容
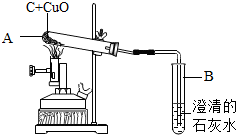
如图所示,将0.1mol氧化铜与一定量的碳混合加热,充分反应(试管中的空气已被除去).
①计算该实验最多可以生成多少克二氧化碳?(请根据化学方程式列式计算)
②实验前后分别称量了装置A和装置B的质量如表中所示.若数据Ⅰ准确,请回答:
a.反应后A中固体的成分是______.
b.数据Ⅱ存在的问题是______,可能的原因是______.
①计算该实验最多可以生成多少克二氧化碳?(请根据化学方程式列式计算)
②实验前后分别称量了装置A和装置B的质量如表中所示.若数据Ⅰ准确,请回答:
a.反应后A中固体的成分是______.
b.数据Ⅱ存在的问题是______,可能的原因是______.
| 反应前质量(g) | 反应后质量(g) | ||
| Ⅰ | 装置A | 125.3 | 124.2 |
| Ⅱ | 装置B | 152 | 152.3 |

①0.1mol氧化铜的质量为:0.1mol×80g/gmol=8g
设生成二氧化碳的质量为x
2CuO+C
2Cu+CO2↑
160 44
8gx
=
解得:x=2.2g
答:该实验最多可以生成2.2克二氧化碳.
②a、氧化铜中氧元素的质量为:8g×(
×100%)=1.6g
根据表格中A组数据可以知道反应前后减少的质量为:125.3g-124.2g=1.1g
1.1g<1.6g
所以可以判断氧化铜没有完全反应,即A中的固体为氧化铜和铜的混合物.
b、根据B中的数据可以知道,被吸收的二氧化碳的质量小于生成的二氧化碳的质量,可能的原因是澄清石灰水的量不足,没有将生成的二氧化碳全部吸收.
故答案为:①2.2g
②氧化铜和铜;数据Ⅱ中反应后的质量偏小;澄清石灰水量不足,没有将生成的二氧化碳全部吸收.
设生成二氧化碳的质量为x
2CuO+C
| ||
160 44
8gx
| 160 |
| 8g |
| 44 |
| x |
解得:x=2.2g
答:该实验最多可以生成2.2克二氧化碳.
②a、氧化铜中氧元素的质量为:8g×(
| 16 |
| 16+64 |
根据表格中A组数据可以知道反应前后减少的质量为:125.3g-124.2g=1.1g
1.1g<1.6g
所以可以判断氧化铜没有完全反应,即A中的固体为氧化铜和铜的混合物.
b、根据B中的数据可以知道,被吸收的二氧化碳的质量小于生成的二氧化碳的质量,可能的原因是澄清石灰水的量不足,没有将生成的二氧化碳全部吸收.
故答案为:①2.2g
②氧化铜和铜;数据Ⅱ中反应后的质量偏小;澄清石灰水量不足,没有将生成的二氧化碳全部吸收.

练习册系列答案
相关题目