题目内容
 20、已知金属钠和水能发生反应:2Na+2H2O=2NaOH+H2↑
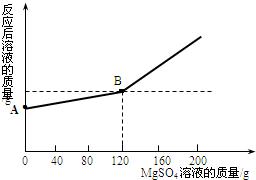
20、已知金属钠和水能发生反应:2Na+2H2O=2NaOH+H2↑现取金属钠4.6 g投入到100 g水中,充分反应后,冷却到室温(20℃),得到一种不饱和溶液.向所得溶液中逐滴滴入MgSO4溶液,实验测得溶液的总质量与滴入MgSO4溶液的质量关系曲线如右图所示.根据题意回答下列问题:
(1)金属钠和水充分反应后,生成氢气的质量为:
0.2
g.(2)图中A点的纵坐标表示的溶液的质量是:
104.4
g.(3)通过计算求出当滴入120 g MgSO4溶液时(即B点),充分反应后溶液的总质量是多少?(计算结果精确至0.1g)
分析:(1)根据金属钠和水反应的化学方程式和钠的质量,列出比例式,就可计算出生成氢气的质量;
(2)由图示可知,图中A点的纵坐标表示的溶液是金属钠和水反应后的氢氧化钠溶液,根据质量守恒定律,其质量为:反应前物质的总质量-生成氢气的质量;
(3)①根据金属钠和水反应的化学方程式和钠的质量,列出比例式,计算出生成NaOH的质量;
②根据硫酸镁与氢氧化钠反应的化学方程式和①中计算出的氢氧化钠质量,列出比例式,就可计算出最终生成Na2SO4的质量和生成Mg(OH)2沉淀的质量;
③反应后溶液的总质量=图中A点的纵坐标表示的溶液是氢氧化钠溶液质量+加入硫酸镁溶液质量-生成沉淀的质量.
(2)由图示可知,图中A点的纵坐标表示的溶液是金属钠和水反应后的氢氧化钠溶液,根据质量守恒定律,其质量为:反应前物质的总质量-生成氢气的质量;
(3)①根据金属钠和水反应的化学方程式和钠的质量,列出比例式,计算出生成NaOH的质量;
②根据硫酸镁与氢氧化钠反应的化学方程式和①中计算出的氢氧化钠质量,列出比例式,就可计算出最终生成Na2SO4的质量和生成Mg(OH)2沉淀的质量;
③反应后溶液的总质量=图中A点的纵坐标表示的溶液是氢氧化钠溶液质量+加入硫酸镁溶液质量-生成沉淀的质量.
解答:解:(1)设生成氢气的质量为x,
2Na+2H2O=2NaOH+H2↑
46 2
4.6g x
∴46:2=4.6g;x,
解之得:x=0.2g;
故答案为:0.2g;
(2)图中A点的纵坐标表示的溶液是氢氧化钠溶液,它的质量为:4.6g+100g-0.2g=104.4g;
故答案为:104.4;
(3)①解:设生成NaOH的质量为x.
2Na+2H2O=2NaOH+H2↑
46 80
4.6g x
∴46:80=4.6g:x,
解之得:x=8g;
②设生成Mg(OH)2的质量为y.
MgSO4+2NaOH=Na2SO4+Mg(OH)2↓
80 58
8g y
∴80:58=8g:y,
解之得:y=5.8g;
③反应后溶液的总质量为:104.4g+120g-5.8g=218.6g.
答:充分反应后溶液的总质量是218.6g.
2Na+2H2O=2NaOH+H2↑
46 2
4.6g x
∴46:2=4.6g;x,
解之得:x=0.2g;
故答案为:0.2g;
(2)图中A点的纵坐标表示的溶液是氢氧化钠溶液,它的质量为:4.6g+100g-0.2g=104.4g;
故答案为:104.4;
(3)①解:设生成NaOH的质量为x.
2Na+2H2O=2NaOH+H2↑
46 80
4.6g x
∴46:80=4.6g:x,
解之得:x=8g;
②设生成Mg(OH)2的质量为y.
MgSO4+2NaOH=Na2SO4+Mg(OH)2↓
80 58
8g y
∴80:58=8g:y,
解之得:y=5.8g;
③反应后溶液的总质量为:104.4g+120g-5.8g=218.6g.
答:充分反应后溶液的总质量是218.6g.
点评:本题主要考查学生利用化学方程式进行计算的能力.

练习册系列答案
 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案 蓝天教育暑假优化学习系列答案
蓝天教育暑假优化学习系列答案
相关题目
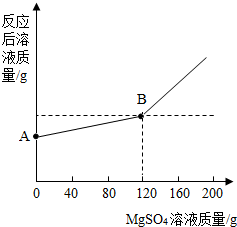 已知金属钠和水能发生下列反应:2Na+2H2O=2NaOH+H2↑
已知金属钠和水能发生下列反应:2Na+2H2O=2NaOH+H2↑