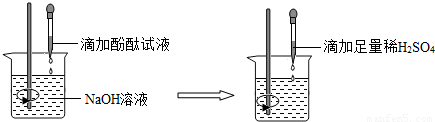
题目内容
(2010?上海)在研究酸和碱的化学性质时,某小组同学想证明:稀H2SO4与NaOH溶液混合后,虽然仍为无色溶液,但确实发生了化学反应.请与他们一起完成实验方案的设计、实施和评价.
(1)方案一:测定稀H2SO4与NaOH溶液混合前后的pH(20℃).
测定某NaOH溶液的pH,pH
将一定量的稀H2SO4加入该NaOH溶液中,混合均匀后测定其pH,pH 小于7.
结论:稀H2SO4与NaOH溶液发生了化学反应,并且
(2)方案二:观察
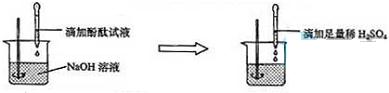
结论:稀H2SO4与NaOH溶液发生了化学反应,反应的化学方程式为
(3)上述两个方案在设计思想上的相同点是
(4)为了进一步获取稀H2SO4与NaOH溶液确实发生了化学反应的证据,依据中和反应是
(1)方案一:测定稀H2SO4与NaOH溶液混合前后的pH(20℃).
测定某NaOH溶液的pH,pH
大于
大于
7(选填“大于”、“等于”或“小于”).将一定量的稀H2SO4加入该NaOH溶液中,混合均匀后测定其pH,pH 小于7.
结论:稀H2SO4与NaOH溶液发生了化学反应,并且
稀H2SO4
稀H2SO4
过量.(2)方案二:观察
向滴有酚酞试液的氢氧化钠溶液中加入足量的稀硫酸,溶液由红色变为无色
向滴有酚酞试液的氢氧化钠溶液中加入足量的稀硫酸,溶液由红色变为无色
.(根据图示实验步骤,概括方案要点)
结论:稀H2SO4与NaOH溶液发生了化学反应,反应的化学方程式为
2NaOH+H2SO4=Na2SO4+2H2O
2NaOH+H2SO4=Na2SO4+2H2O
.(3)上述两个方案在设计思想上的相同点是
混合前后溶液的酸碱性是否发生了变化
混合前后溶液的酸碱性是否发生了变化
.(4)为了进一步获取稀H2SO4与NaOH溶液确实发生了化学反应的证据,依据中和反应是
放热
放热
(选填“放热”、“吸热”或“无热量变化”)的反应,采用同温下的稀H2SO4与NaOH溶液进行实验,整个实验中至少需要测定溶液温度三
三
次.分析:氢氧化钠溶液呈碱性,其PH大于7,能使酚酞试液变红,硫酸呈酸性,其PH小于7,不能使酚酞试液变色,氢氧化钠和硫酸反应能生成硫酸钠和水,该反应为放热反应.
解答:解:(1)氢氧化钠溶液呈碱性,其PH大于7,硫酸呈酸性,其PH小于7,所以本题答案为:大于,稀H2SO4;
(2)由图示可以看出,此实验为向滴有酚酞的氢氧化钠溶液中加入足量的稀硫酸,氢氧化钠和硫酸反应生成硫酸钠和水,根据酚酞在酸碱溶液中的颜色变化,所以本题答案为:向滴有酚酞试液的氢氧化钠溶液中加入足量的稀硫酸,溶液由红色变为无色,2NaOH+H2SO4=Na2SO4+2H2O;
(3)无论是测溶液的PH,还是酚酞颜色的变化,都与溶液的酸碱性变化有关,所以本题答案为:混合前后溶液的酸碱性是否发生了变化;
(4)中和反应为放热反应,可以通过测定反应前后溶液的温度变化来进行确定,反应前测起始温度,反应中测温度是否升高,加入过量的硫酸再测溶液的温度是否降低,所以本题答案为:放热,三.
(2)由图示可以看出,此实验为向滴有酚酞的氢氧化钠溶液中加入足量的稀硫酸,氢氧化钠和硫酸反应生成硫酸钠和水,根据酚酞在酸碱溶液中的颜色变化,所以本题答案为:向滴有酚酞试液的氢氧化钠溶液中加入足量的稀硫酸,溶液由红色变为无色,2NaOH+H2SO4=Na2SO4+2H2O;
(3)无论是测溶液的PH,还是酚酞颜色的变化,都与溶液的酸碱性变化有关,所以本题答案为:混合前后溶液的酸碱性是否发生了变化;
(4)中和反应为放热反应,可以通过测定反应前后溶液的温度变化来进行确定,反应前测起始温度,反应中测温度是否升高,加入过量的硫酸再测溶液的温度是否降低,所以本题答案为:放热,三.
点评:本题考查了酸碱中和反应,完成此题,可以依据已有的知识进行,所以要求同学们在平时的学习中加强基础知识的储备.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
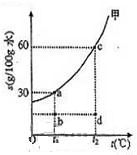 (2010?上海)甲物质在水中的溶解度曲线如图,a、b、c、d为图象中的四个点.
(2010?上海)甲物质在水中的溶解度曲线如图,a、b、c、d为图象中的四个点.