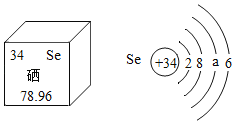
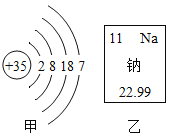
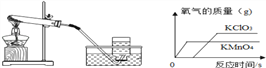
��Ŀ����
����Ŀ���ס����Թ��и�ʢ��10.0gˮ��������һ֧�Թ��м���3.0g Na2CO3��ĩ����һ֧�Թ��м���3.0gNaCl��ĩ����ͼ1��2����ʵ�顣����˵����ȷ����
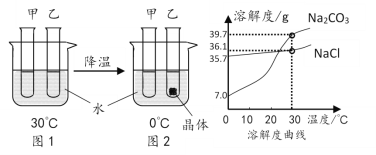
A. 0��ʱ��������Һһ�������ͣ�������Һһ������
B. ���м���ķ�ĩ��Na2CO3
C. Na2CO3�к�������NaCl��������ȴ�ȱ�����Һ�ķ����ᴿNa2CO3
D. 30��ʱ����ʹͼ1�мס����Թ��ڵ���Һǡ�ñ�Ϊ��Ӧ������Һ�����м����Ӧ�����������������м����Ӧ����������
���𰸡�AC
��������
A��ͨ���Ƶ���֪�������Ȼ��ƣ�0��ʱ���Ȼ��Ƶ��ܽ����35.7g�����Լ�����Һһ�������ͣ�������Һһ�����ͣ���A��ȷ��
B��0��ʱ��̼���Ƶ��ܽ����7g������10gˮ�п����ܽ�0.7g�����ձ��ײ��й���ʣ�࣬���Լ��м���ķ�ĩ���Ȼ��ƣ���B����
C��̼���Ƶ��ܽ�����¶ȱ仯Ӱ��ϴ�����Na2CO3�к�������NaC1��������ȴ�ȱ�����Һ�ķ����ᴿ̼���ƣ���C��ȷ��
D��30��ʱ��̼���Ƶ��ܽ�ȴ����Ȼ��Ƶ��ܽ�ȣ�������ʹͼ1�мס����Թ��ڵ���Һǡ�ñ�Ϊ��Ӧ������Һ�����м����Ӧ����������С�����м����Ӧ��������������D����
��ѡAC��

����Ŀ���ҹ������˿�Լ14�ڣ�ˮ��Դ����ԼΪ2.8��1012m3��ˮ�Ľ�ȱ�̶����˾�ˮ���Ĺ�ϵ���£�
�˾�ˮ��/m3 | С��500 | 500��1000 | 1000��1700 | 1700��3000 |
��ȱ�̶� | ����ȱˮ | ����ȱˮ | �ж�ȱˮ | ���ȱˮ |
��1�����ݼ����ҹ����˾�ˮ���ж��ҹ���ˮ��Դ��ȱ�̶�Ϊ_____��
��2��ˮ��Դ�Ķ�ȱ�ܴ�һ����ԭ��������ˮ���ܵ���Ⱦ���йز����ô�������̿������ˮ�ʣ����������˻���̿��_____�ԣ����ַ���������õ���ˮ��_____����������������
��3��Ϊ��������ˮ��Դ����˵�������е�һ���Լ��ˮ���ֹˮ��Ⱦ�ľ���������_____