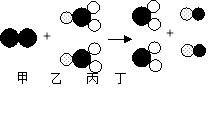
题目内容
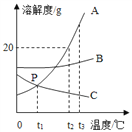
【题目】A~H分别是氢、氧、碳、氮、钠、钙六种元素中的一种或几种组成的初中化学常见物质,如图所示(箭头表示物质间能转化,实线表示物质间能反应)。请回答下列问题。
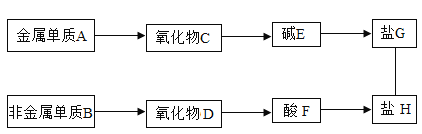
(1)若B常温下为固态,则B的化学式是____,F的化学式是_______。
(2)若B常温下为气态,则A的化学式是_________。
(3)G+H反应的化学方程式为_______;此反应属于_____(填基本反应类型)反应。
【答案】C H2CO3 N2 Ca(NO3)2+Na2CO3=CaCO3↓+2NaNO3 复分解
【解析】
(1)B为非金属单质,则组成元素可能为氢、氧、氮、碳,若B常温下为固态,则B为碳单质,碳的氧化物有二氧化碳和一氧化碳,但能够生成酸的只有二氧化碳,所以D为二氧化碳,二氧化碳溶于水生成碳酸,所以F为碳酸,化学式为H2CO3,故填:H2CO3。
(2)B为非金属单质,则组成元素可能为氢、氧、氮、碳,若B常温下为气态,则B可能为氢气、氧气或氮气。已知G和H为盐,发生复分解反应,反应生成沉淀,根据题干给的元素种类,可以推知两者为Na2CO3和Ca(NO3)2若G为Na2CO3,H为Ca(OH)2,则A为Na, C为Na2O,E为NaOH,F为HNO3, D为NO2或H2O,B为N2或H2,符合题意,若G为Ca(NO3)2 则A为Ca, C为CaO,E为Ca(OH)2,B为O2或H2,D为H2O,F为H2CO3,H为碳酸钠,也符合题意,故A为Na或Ca。
(3) 已知G和H为盐,发生复分解反应,反应生成沉淀,根据题干给的元素种类,可以推知两者为Na2CO3和Ca(NO3)2,化学方程式为Ca(NO3)2+Na2CO3=CaCO3↓+2NaNO3,故填:Ca(NO3)2+Na2CO3=CaCO3↓+2NaNO3;复分解。

【题目】小江同学为了寻找含碳酸钙质量分数超过85%的石灰石,对一样品进行了如下定量实验(石灰石样品中的杂质不与盐酸反应).
实验步骤 | 将适量盐酸加入烧杯中并称重 | 称取少量石灰石样品加入烧杯中,使之与过量稀盐酸反应 | 待反应完全后,称重 |
实验数据 | 烧杯和盐酸的质量为100.0g | 石灰石样品的质量为12.0g | 烧杯和其中混合物的质量为107.6g |
试通过计算,分析该石灰石样品中碳酸钙的质量分数是否符合要求?_____