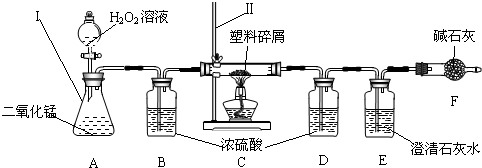
题目内容
化学小组的同学在实验室测定某电镀厂所用CuSO4溶液中溶质的质量分数.取该CuSO4溶液50g向其中加入某未知溶质质量分数的NaOH溶液40g,二者恰好完全反应.生成沉淀4.9g.
计算:①CuSO4溶液中溶质的质量分数.
②求所得溶液的溶质质量分数.
计算:①CuSO4溶液中溶质的质量分数.
②求所得溶液的溶质质量分数.
分析:根据化学反应方程式列式计算,根据生成Cu(OH)2沉淀的质量可求出参加反应的CuSO4质量,进而可求出CuSO4溶液中溶质的质量分数;
解答:解:①设50g CuSO4溶液中所含CuSO4质量为x,生成硫酸钠质量是y
CuSO4+2NaOH═Na2SO4+Cu(OH)2↓
160 142 98
x y 4.9g
=
=
x=8g y=7.1g
CuSO4溶液中溶质的质量分数=
×100%=16%
②反应后所得溶液的质量=50g+40g-4.9g=85.1g,则所得溶液的溶质质量分数为
×100%=8.3%.
答:①CuSO4溶液中溶质的质量分数为16%.②求所得溶液的溶质质量分数为8.3%.
CuSO4+2NaOH═Na2SO4+Cu(OH)2↓
160 142 98
x y 4.9g
| 160 |
| x |
| 98 |
| 4.9g |
| 142 |
| y |
x=8g y=7.1g
CuSO4溶液中溶质的质量分数=
| 8g |
| 50g |
②反应后所得溶液的质量=50g+40g-4.9g=85.1g,则所得溶液的溶质质量分数为
| 7.1g |
| 85.1g |
答:①CuSO4溶液中溶质的质量分数为16%.②求所得溶液的溶质质量分数为8.3%.
点评:本题考查学生利用化学反应方程式来进行的有关计算,学生应明确物质能否反应,发生的什么反应,熟悉常见的化学反应是解答此类习题的关键.

练习册系列答案
相关题目
 石油中主要含有碳和氢两种元素,利用石油中各成分的沸点不同,将它们分离(称为分馏),可得到不同的产品,使石油得到综合利用.(如图).化学科技工作者把燃料油中较大的分子裂解成含二个、三个、四个碳原子等的小分子,然后把它们加工制成各种产品,如塑料、合成纤维、合成橡胶、药物、农药、炸药、化肥等等.
石油中主要含有碳和氢两种元素,利用石油中各成分的沸点不同,将它们分离(称为分馏),可得到不同的产品,使石油得到综合利用.(如图).化学科技工作者把燃料油中较大的分子裂解成含二个、三个、四个碳原子等的小分子,然后把它们加工制成各种产品,如塑料、合成纤维、合成橡胶、药物、农药、炸药、化肥等等.