��Ŀ����
����Ŀ��Ī��ͬѧ���þ��ϡ���ᷴӦ��ʵ���ң��۲쵽�лҰ�ɫ�������ɵġ��쳣������������������Ȥ��������������̽����
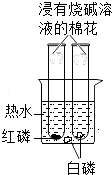
��1��������̽�������ֻҰ�ɫ�����Ƿ�ΪżȻ���� ��ʵ�����4����ͬ�����Ũ�ȵ�ϡ�����зֱ����һ�����ȵ�ij��þ�����������£�
ʵ����� | A | B | C | D |
þ������ | 1cm | 2cm | 3cm | 4cm |
������ | �������� | �������� | �����϶� | �����ܶ� |
��ʵ����ۡ�����żȻ���ݱ���������ʵ����֡��쳣������Ҫ���أ�
���ٴ�̽�����ó����ijɷ�
��������衿����1��Mg������2��MgCl2
��ʵ���
��� | ʵ����� | ʵ������ | ʵ����� |
�� | ȡ1g��Ʒ���������� | δ������ | ����1���� |
�� | ȡ1g��Ʒ������5mL����ˮ���� | ����δ�ܽ� | ����2���� |
�� | ȡ1g MgCl2���壬��5mL����ˮ���� | ����ȫ���ܽ� |
��2�����������ۡ� ��Ī��ͬѧ��������������������Ϊ��Ӧ��Mg��������������2������������Ϊ������MgCl2 ��
�ڴ�ʵ����ƵĽǶȽ���ʵ��۵������� ��
��3��������̽�����ó������������ ���������ϡ�
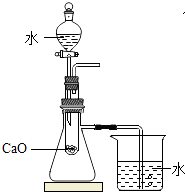
�Ұ�ɫ�����ijɷ�Ϊ��ʽ�Ȼ�þ�������ڶ�����ɣ���ѧʽ�ɱ�ʾΪMgx��OH��yClznH2O[��ÿ��Mgx��OH��yClz�����n��H2O]�������ȷֽ�ɲ�������þ���Ȼ����ˮ��
��ʵ���
ϴȥ�����������ʲ��������ɣ�ȡ��7.07g������ͼװ�ã��г�����δ������������ȷ�IJ����������ʵ�飬����Ӧֹͣ���Ӳ�ʲ�������ʣ���������Ϊ4.00g��װ��B������������2.34g��
���������ۡ�
�ٷ�Ӧֹͣ��Ӧ����ͨ��N2һ��ʱ�䣬Ŀ���� ��
�ڸó����У�þ���ȵ����Ӹ�����n��Mg2+����n��Cl����= ��
��������Mgx��OH��yClznH2O�У�n=5����X��Y��Z����ֵ����Ϊ �� 
���𰸡�
��1��þ�����̣�ϡ����
��2��������ˮ�����жԱ�
��3��ʹ��Ӧ���ɵ�ˮ������ȫ��Ũ�������գ�5��1��10��18��2
���������⣺��ʵ����ۡ����ݱ����ṩ����Ϣ���Կ�����þ��������ʵ����֡��쳣������Ҫ���أ����þ�����̣���ʵ�����1����˵������������Ʒ��Ӧ���������ϡ��� ���������ۡ���1����������2������������Ϊ������MgCl2 ������ˮ�����������ˮ����2��ʵ��۵������ǽ���ʵ��Աȣ�������жԱȣ�
���������ۡ���1������Ũ��������ˮ����������Һ�������Ȼ������壬�ʷ�Ӧֹͣ��Ӧ����ͨ��N2һ��ʱ�䣬Ŀ����ʹ��Ӧ���ɵ�ˮ������ȫ��Ũ�������գ����ʹ��Ӧ���ɵ�ˮ������ȫ��Ũ�������գ���2��Ӳ�ʲ�������ʣ���������Ϊ4.00g����þԪ�ص�����Ϊ��4.00g�� ![]() =2.4g��װ��B������������2.34g����Cװ�����ӵ�����Ϊ��7.07g��4.00g��2.34g=0.73g������Ԫ�ص�����Ϊ��0.73g��
=2.4g��װ��B������������2.34g����Cװ�����ӵ�����Ϊ��7.07g��4.00g��2.34g=0.73g������Ԫ�ص�����Ϊ��0.73g�� ![]() =0.71g���ó����У�þ���ȵ����Ӹ�����n��Mg2+����n��Cl����=
=0.71g���ó����У�þ���ȵ����Ӹ�����n��Mg2+����n��Cl����= ![]() =5��1����3��������������þ���Ȼ����ˮ���ӵĸ�����Ϊ��
=5��1����3��������������þ���Ȼ����ˮ���ӵĸ�����Ϊ�� ![]() =10��2��13��������Mgx��OH��yClznH2O�У�n=5����ԭ�ӵ�����Ϊ28����y=16������x��y��z����ֵ����Ϊ10��18��2�����10��18��2��
=10��2��13��������Mgx��OH��yClznH2O�У�n=5����ԭ�ӵ�����Ϊ28����y=16������x��y��z����ֵ����Ϊ10��18��2�����10��18��2��
�����㾫����������Ŀ����֪���������ý������ϵ�ѡ�����ݵ����֪ʶ���Եõ�����Ĵ𰸣���Ҫ���պ�ɫ������ͨ��ָ�����̡��������ǵĺϽ��ؽ�������ͭ��п��Ǧ�ȣ���ɫ��������������ơ�þ�����ȣ���ɫ������ͨ����ָ����ɫ�������������������

����Ŀ���ס��ҡ�����X��ת����ϵ��ͼ��ʾ����Ӧ�����Ͳ��ֲ�������ȥ����������ʾһ��ת���������и����У���������ͼʾת����ϵ���ǣ� �� 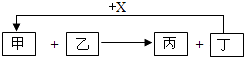
�� | �� | �� | X | |
A | ������ | ������ | ���� | ���� |
B | �� | �� | ������ | ������ |
C | �� | �� | �� | ������ |
D | ���� | �� | �� | �� |
A.A
B.B
C.C
D.D