题目内容
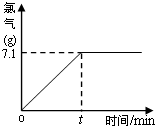 (2009?通州区一模)氯化钠除了用做调味品外,还是一种重要的化工原料.氯碱厂用给氯化钠溶液通电的方法可制得氢氧化钠、氯气和氢气.某实验小组同学在老师帮助下,取一定质量含氯化钠质量分数为10%的溶液进行电解,当氯化钠完全反应后,停止通电.下图是他们对生成的氯气质量与时间关系所做的分析记录.试计算:
(2009?通州区一模)氯化钠除了用做调味品外,还是一种重要的化工原料.氯碱厂用给氯化钠溶液通电的方法可制得氢氧化钠、氯气和氢气.某实验小组同学在老师帮助下,取一定质量含氯化钠质量分数为10%的溶液进行电解,当氯化钠完全反应后,停止通电.下图是他们对生成的氯气质量与时间关系所做的分析记录.试计算:(1)参加反应的氯化钠质量是多少?
11.7g
11.7g
(2)完全反应后所得溶液的质量分数是多少?
7.3%
7.3%
.分析:依据题干信息书写化学方程式;
(1)根据方程式由图中所给的氯气质量可直接求出参加反应的NaCl质量和H2质量;
(2)根据NaCl溶液电解的化学方程式,利用氯气质量可得到生成的氢氧化钠的质量,进而求出氢氧化钠的质量分数.
(1)根据方程式由图中所给的氯气质量可直接求出参加反应的NaCl质量和H2质量;
(2)根据NaCl溶液电解的化学方程式,利用氯气质量可得到生成的氢氧化钠的质量,进而求出氢氧化钠的质量分数.
解答:解:有题干信息“氯化钠溶液通电的方法可制得氢氧化钠、氯气和氢气”可得该反应的化学方程式为:2NaCl+2H2O
Cl2↑+H2↑+2NaOH;
(1)设参加反应的NaCl的质量为x,生成H2的质量为y
2NaCl+2H2O
Cl2↑+H2↑+2NaOH
117 71 2 80
x 7.1g y z
=
=
=
x=11.7g y=0.2g z=8g
(2)氯化钠溶液质量为
═117g
完全反应后NaOH溶液中NaOH的质量分数为:
×100%≈7.3%
答:(1)11.7g;(2)7.3%.
| ||
(1)设参加反应的NaCl的质量为x,生成H2的质量为y
2NaCl+2H2O
| ||
117 71 2 80
x 7.1g y z
| 117 |
| x |
| 71 |
| 7.1g |
| 2 |
| y |
| 80 |
| z |
x=11.7g y=0.2g z=8g
(2)氯化钠溶液质量为
| 11.7g |
| 10% |
完全反应后NaOH溶液中NaOH的质量分数为:
| 8g |
| 117g+7.1g-0.2g |
答:(1)11.7g;(2)7.3%.
点评:此题是对化学方程计算的考查题,解题的关键是能够正确的书写有关的方程式和利用质量守恒定律计算所得溶液的溶质质量分数;

练习册系列答案
 高中必刷题系列答案
高中必刷题系列答案
相关题目
 (2009?通州区一模)图为某反应的微观粒子示意图,其中的不同色彩小球代表不同的原子.下列各反应中,与下图所示反应类型相符合的是( )
(2009?通州区一模)图为某反应的微观粒子示意图,其中的不同色彩小球代表不同的原子.下列各反应中,与下图所示反应类型相符合的是( )