题目内容
某校化学研究性学习小组了解到,某石材厂新购进一批石灰石原料,其所含的杂质既不溶于水,也不溶于盐酸,高温时也不发生反应.甲、乙、丙、丁四位同学分别取某石灰石样品,并取稀盐酸200g平均分成4份,进行实验,结果如下:
| 实验 | 甲 | 乙 | 丙 | 丁 |
| 加入样品的质量/g | 5 | 10 | 15 | 20 |
| 生成CO2的质量/g | 1.76 | 3.52 | 4.40 | m |
解:(1)5g样品与50g盐酸反应生成1.76g二氧化碳,10g样品与50g盐酸反应生成3.52g二氧化碳,样品质量增加了一倍,生成的二氧化碳质量也增加了一倍,说明5g样品与50g盐酸反应只能生成1.76g二氧化碳,加入15g样品时,由于样品的质量是5g的三倍,所以生成二氧化碳的质量也是1.76g的 三倍即:1.76g×3=5.28g,但实际生成二氧化碳4.40g,说明样品并没有完全反应,盐酸被反应完了,即50g盐酸完全反应完只能生成4.40g二氧化碳,所以加入的样品再多,生成二氧化碳的质量也是4.40g;
(2)解:设10g样品中含碳酸钙的质量为x.
CaCO3+2HCl═CaCl2+H2O+CO2↑
100 44
X 3.52g
根据: 解得X=8g,所以
解得X=8g,所以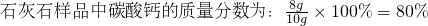
(3)解:设50g盐酸溶液中溶质的质量为y.
CaCO3+2HCl═CaCl2+H2O+CO2↑
73 44
Y 4.4g
根据: 解得Y=7.3g,所以盐酸中溶质的质量分为:
解得Y=7.3g,所以盐酸中溶质的质量分为: ×100%=14.6%.
×100%=14.6%.
故答案为:(1)4.40g;(2)80%;(3)14.6%.
分析:(1)5g样品与50g盐酸反应生成1.76g二氧化碳,10g样品与50g盐酸反应生成3.52g二氧化碳,样品质量增加了一倍,生成的二氧化碳质量也增加了一倍,说明5g样品与50g盐酸反应只能生成1.76g二氧化碳,再根据加入的样品质量与5g的关系进行分析;(2)根据生成的二氧化碳的质量算出碳酸钙的质量,再除以样品的质量;(3)根据二氧化碳的质量计算出氯化氢的质量,再除以50g盐酸质量即可.
点评:解答本题关键是要知道根据图表中数据分析哪种物质过量的方法,计算样品中碳酸钙含量时,必须要根据样品完全反应的那次进行计算,计算盐酸质量分数时,要根据盐酸完全反应的那次进行计算.
(2)解:设10g样品中含碳酸钙的质量为x.
CaCO3+2HCl═CaCl2+H2O+CO2↑
100 44
X 3.52g
根据:
 解得X=8g,所以
解得X=8g,所以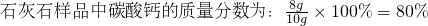
(3)解:设50g盐酸溶液中溶质的质量为y.
CaCO3+2HCl═CaCl2+H2O+CO2↑
73 44
Y 4.4g
根据:
 解得Y=7.3g,所以盐酸中溶质的质量分为:
解得Y=7.3g,所以盐酸中溶质的质量分为: ×100%=14.6%.
×100%=14.6%.故答案为:(1)4.40g;(2)80%;(3)14.6%.
分析:(1)5g样品与50g盐酸反应生成1.76g二氧化碳,10g样品与50g盐酸反应生成3.52g二氧化碳,样品质量增加了一倍,生成的二氧化碳质量也增加了一倍,说明5g样品与50g盐酸反应只能生成1.76g二氧化碳,再根据加入的样品质量与5g的关系进行分析;(2)根据生成的二氧化碳的质量算出碳酸钙的质量,再除以样品的质量;(3)根据二氧化碳的质量计算出氯化氢的质量,再除以50g盐酸质量即可.
点评:解答本题关键是要知道根据图表中数据分析哪种物质过量的方法,计算样品中碳酸钙含量时,必须要根据样品完全反应的那次进行计算,计算盐酸质量分数时,要根据盐酸完全反应的那次进行计算.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
为了测定某品牌食用纯碱中碳酸钠的质量分数,某校化学研究性学习小组的探究过程如下:
[提出问题]样品中碳酸钠的质量分数是多少?
[知识准备]
食用纯碱的主要成分是碳酸钠,另外还含有少量的氯化钠;反应过程中不考虑水和氯化氢的挥发.
[设计方案并实验]
甲组同学:称取12.00样品,加水配成溶液,在溶液中加入过量澄清石灰水,过滤、洗涤、干燥,共得到白色沉淀10.00g.
乙组同学:称取12.00样品,加入足量的稀盐酸直到反应停止,共收集到4.4g二氧化碳.
[解决问题]
请你任选一组同学的实验结果,帮助他们计算出样品中碳酸钠的质量是 ,碳酸钠的质量分数是 .(计算结果精确到0.1%)
[交流反思]
(1)甲组的小青同学认为,要求出碳酸钠的质量,也可以使用与盐酸和石灰水所属类别不同的其他物质 (填一种具体物质的化学式)的溶液与样品反应,通过测定相关物质的质量,进行有关计算即可.
(2)乙组的小雨同学认为,所用稀盐酸的溶质质量分数也可求出:取13.5g样品放入烧杯中,每次加入20g稀盐酸(不考虑水、氯化氢逸出)后用精密仪器称量,记录实验数据如下:
表中数据a= g,b= g.并请你在下边的坐标纸上绘制生成气体的质量与所加稀盐酸质量关系的曲线.
[提出问题]样品中碳酸钠的质量分数是多少?
[知识准备]
食用纯碱的主要成分是碳酸钠,另外还含有少量的氯化钠;反应过程中不考虑水和氯化氢的挥发.
[设计方案并实验]
甲组同学:称取12.00样品,加水配成溶液,在溶液中加入过量澄清石灰水,过滤、洗涤、干燥,共得到白色沉淀10.00g.
乙组同学:称取12.00样品,加入足量的稀盐酸直到反应停止,共收集到4.4g二氧化碳.
[解决问题]
请你任选一组同学的实验结果,帮助他们计算出样品中碳酸钠的质量是
[交流反思]
(1)甲组的小青同学认为,要求出碳酸钠的质量,也可以使用与盐酸和石灰水所属类别不同的其他物质
(2)乙组的小雨同学认为,所用稀盐酸的溶质质量分数也可求出:取13.5g样品放入烧杯中,每次加入20g稀盐酸(不考虑水、氯化氢逸出)后用精密仪器称量,记录实验数据如下:
| 加入盐酸的次数 | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
| 烧杯及所称物质总质量/g | 78.9 | 97.8 | 116.7 | 135.60 | 155.05 | 175.05 | 195.05 |
| 生成气体的质量/g | 1.1 | 2.2 | a | 4.4 | 4.95 | b | -- |

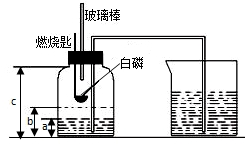 某校化学研究性学习小组在学习了“空气中氧气含量测定”的基础上,改进了教材中的实验,设计出了如图所示的实验装置.实验步骤如下:
某校化学研究性学习小组在学习了“空气中氧气含量测定”的基础上,改进了教材中的实验,设计出了如图所示的实验装置.实验步骤如下: