题目内容
【题目】M是生活中常见的金属,MSO4溶液是无色液体,某化学兴趣小组的同学欲探究M与铜、铝的活动性顺序,请你和他们一起进行以下探究活动.
【提出问题】M、铜、铝的金属活动性顺序是怎样的?
(1)【猜想与假设】小敏的猜想是Al>Cu>M;小强的猜想是Al>M>Cu;你的猜想是 .
(2)【设计与实验一】小莉取M丝、铜丝、铝丝和编号为①、②、③的3支试管,进行如表的实验(试管中均盛有体积相同、溶质质量分数也相同的稀盐酸);
实验操作 | M丝插入试管①中 | 铜丝插入试管②中 | 铝丝插入试管③中 | 实验结论 |
刚开始的现象 | 有少量气泡产生 | 无气泡 | 无气泡 | M>Cu: |
几分钟后的现象 | 有少量气泡产生 | 无气泡 | 有大量气泡产生 |
(3)【交流与表达】同学们对同一实验得出两种不同结论的现象进行了讨论,明白了实验刚开始时试管③中无气泡产生的原因,该原因是。
(4)【设计与实验二】为了进一步探究三种金属的活动性顺序,同学们取粗细相同,打磨干净的M丝、铝丝及相关溶液,又进行了如图所示的实验: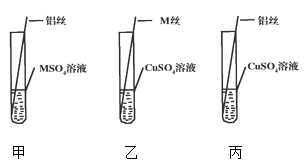
①试管乙中观察到的现象是。
②试管丙中反应的化学方程式为。
(5)【交流与表达】同学们经讨论后认为该实验可以优化,去掉试管(填试管编号)中的实验,也可以得出正确的结论.
【解释与结论】通过以上实验,同学们得出了三种金属的活动性顺序.
(6)【评价与反思】实验结束后,同学们对实验过程进行了如下反思:
①影响金属与酸反应速率快慢的因素,除了相互反应的金属和酸的性质外,还有(任写一种)。
②探究金属活动性顺序时,除了上述实验中已经用到的两种方法外,还可以根据进行判断(任写一种)。
【答案】
(1)M>Al>Cu
(2)M>Al,Al>M>Cu
(3)铝表面有一层氧化膜
(4)M表面出现一层红色物质,2Al+3CuSO4=Al2(SO4)3+3Cu
(5)丙
(6)反应物接触面积、温度等,与氧气反应的剧烈程度
【解析】【提出问题】通过分析小敏、小强同学的猜想可知,我的猜想是M>Al>Cu;
【设计与实验一】金属越活泼,与酸反应生成氢气的反应越剧烈,所以
实验操作 | M丝插入试管①中 | 钢丝插入试管②中 | 铝丝插入试管③中 | 实验结论 |
刚开始的现象 | 有少量气泡产生 | 无气泡 | 无气泡 | M>Cu,M>Al |
几分钟后的现象 | 有少量气泡产生 | 无气泡 | 有大量气泡产生 | Al>M>Cu |
【交流与表达】铝和空气中的氧气反应会生成致密的氧化铝薄膜,所以实验刚开始时试管③中无气泡产生的原因是:铝表面有一层氧化膜;【设计与实验二】①M的金属活动性大于铜的金属活动性,所以试管乙中观察到的现象是:M表面出现一层红色物质;②铝和硫酸铜反应生成硫酸铝和铜,化学方程式为:2Al+3CuSO4=Al2(SO4)3+3Cu;【交流与表达】甲实验可以验证铝比M活泼,乙实验可以证明M比铜活泼,所以三种金属的活动性顺序是Al>M>Cu,所以去掉试管丙中的实验,也可以得出正确的结论;【评价与反思】①影响金属与酸反应速率快慢的因素,除了相互反应的金属和酸的性质外,还有反应物接触面积、温度等;②金属会与酸、盐、氧气等物质反应,所以除了上述实验中已经用到的两种方法外,还可以根据与氧气反应的剧烈程度进行判断。
故答案为:(1)M>Al>Cu;(2)M>Al;Al>M>Cu;(3)铝表面有一层氧化膜(4)M表面出现一层红色物质;2Al+3CuSO4=Al2(SO4)3+3Cu;(5)丙;(6)反应物接触面积、温度等;与氧气反应的剧烈程度
【猜想与假设】根据其余两种猜想来完成第三种猜想
【设计与实验一】根据金属与酸的反应剧烈程度可解答
【交流与表达】根据铝和氧气的反应,及反应后生成的产物性质解答
【设计与实验二】M的活动性比铜强,铝和硫酸铜反应生成铜和硫酸铝
【交流与表达】根据三个实验得出的金属活动性顺序解答
【评价与反思】影响金属与酸反应的因素有相互反应的金属和酸的性质、反应物接触面积、温度等;根据金属的化学性质可解答

 出彩同步大试卷系列答案
出彩同步大试卷系列答案