题目内容
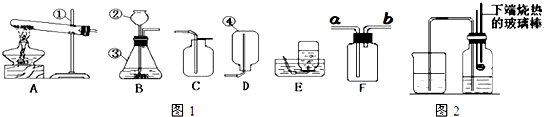
图1是实验室常用的装置,请回答下列问题:
(1)写出仪器①的名称________.收集某气体能采用E装置,由此推测该气体具有的性质是________.
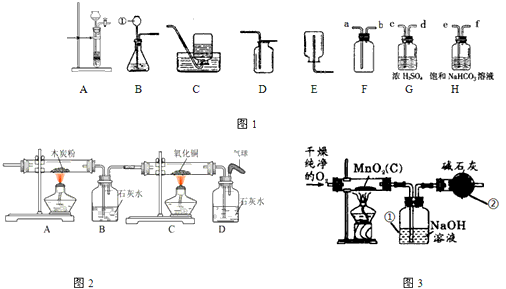
(2)实验室制备并收集氧气的装置组合是________(填装置序号),反应的化学方程式为________;若用F装置收集该气体,则气体应从________ 端进入(填“a”或“b”);装置A、B都可以用来制取二氧化碳,比较这两个装置,指出A装置的一个突出优点是________.
(3)实验室制得的CO2气体中常含有HCl和水蒸气,为了得到纯净、干燥的CO2气体,除杂装置的导管气流方向连接顺序是________(填选项字母编号).
A.c→d→e→f B.d→c→e→f C.e→f→c→d D.f→e→d→c
(4)将氧气通入如图2所示的装置,实验中观察到B中澄清石灰水变浑浊,C中黑色固体变为红色,则进入装置B的气体一定含有________,B处发生反应的化学方程式是________.
(5)实验室制取氧气时常用二氧化锰作催化剂.某二氧化锰样品中含有杂质炭,为测定该样品中二氧化锰的质量分数,某兴趣小组设计的实验方案是:在一定量的样品中通入干燥纯净的氧气,使杂质炭在加热条件下反应生成CO2来进行分析测定.
①如图3所示是用干燥纯净的氧气与样品反应来测定二氧化锰质量分数的装置,仪器②中装有碱石灰(氧化钙和氢氧化钠的混合物),其作用是________.
②为验证装置①已将CO2吸收完全,可在装置①与②之间加入________装置进行证明.
③现称取5.0g二氧化锰样品进行实验,装置①反应前后的质量差为1.1g,则样品中二氧化锰的质量分数为多少?(写出计算过程)
解:(1)长颈漏斗方便加液体药品,收集密度比空气小的气体,可以用向下排空气法,故答案为:长颈漏斗;密度比空气小
(2)制取装置包括加热和不需加热两种,如果用双氧水制氧气就不需要加热,氧气的密度比空气的密度大,不易溶于水,因此能用向上排空气法和排水法收集;若用F装置收集氧气,因为氧气的密度比空气的密度大,因此应该从长管进入;装置A、B都可以用来制取二氧化碳,比较这两个装置,A装置的优点是:可以随时控制反应的发生和停止.故答案为:A(或B)C(或D);2H2O2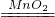 2H2O+O2↑;a;可以随时控制反应的发生和停止
2H2O+O2↑;a;可以随时控制反应的发生和停止
(3)CO2气体中常含有HCl和水蒸气,要先除去氯化氢气体,再干燥,因此应该是e→f→c→d;故答案为:C
(4)将氧气通入如图2所示的装置,实验中观察到B中澄清石灰水变浑浊,C中黑色固体变为红色,则进入装置B的气体一定含有一氧化碳和二氧化碳;二氧化碳与氢氧化钙溶液反应生成碳酸钙白色沉淀和水,故答案为:一氧化碳和二氧化碳;CO2+Ca(OH)2═CaCO3↓+H2O;
(5)仪器②中装有碱石灰的干燥管的作用是:吸收空气中的二氧化碳;为验证装置①已将CO2吸收完全,可在装置①与②之间加入盛有澄清石灰水的洗气瓶;故答案为:①吸收空气中的二氧化碳;②盛有澄清石灰水的洗气瓶
③解:设二氧化锰样品中含有杂质炭的质量为x
C+O2 CO2
CO2
12 44
x 1.1g
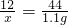 x=0.3g
x=0.3g
样品中二氧化锰的质量分数=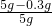 ×100%=94% 答:样品中二氧化锰的质量分数是94%
×100%=94% 答:样品中二氧化锰的质量分数是94%
故答案为:94%
分析:制取装置包括加热和不需加热两种,如果用双氧水制氧气就不需要加热,如果用高锰酸钾或氯酸钾制氧气就需要加热.氧气的密度比空气的密度大,不易溶于水,因此能用向上排空气法和排水法收集.若用F装置收集氧气,因为氧气的密度比空气的密度大,因此应该从长管进入;装置A、B都可以用来制取二氧化碳,比较这两个装置,A装置的优点是:可以随时控制反应的发生和停止.CO2气体中常含有HCl和水蒸气,要先除去氯化氢气体,再干燥;二氧化碳一般用澄清的石灰水来检验,一氧化碳用灼热的氧化铜来检验;有关的计算要准确.
点评:本考点主要考查气体的制取装置和收集装置的选择,同时也考查了化学方程式的书写和有关的计算,综合性比较强.书写化学方程式时,要注意配平,有关的计算要准确,本考点是中考的重要考点之一,主要出现在实验题和计算题中.
(2)制取装置包括加热和不需加热两种,如果用双氧水制氧气就不需要加热,氧气的密度比空气的密度大,不易溶于水,因此能用向上排空气法和排水法收集;若用F装置收集氧气,因为氧气的密度比空气的密度大,因此应该从长管进入;装置A、B都可以用来制取二氧化碳,比较这两个装置,A装置的优点是:可以随时控制反应的发生和停止.故答案为:A(或B)C(或D);2H2O2
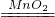 2H2O+O2↑;a;可以随时控制反应的发生和停止
2H2O+O2↑;a;可以随时控制反应的发生和停止(3)CO2气体中常含有HCl和水蒸气,要先除去氯化氢气体,再干燥,因此应该是e→f→c→d;故答案为:C
(4)将氧气通入如图2所示的装置,实验中观察到B中澄清石灰水变浑浊,C中黑色固体变为红色,则进入装置B的气体一定含有一氧化碳和二氧化碳;二氧化碳与氢氧化钙溶液反应生成碳酸钙白色沉淀和水,故答案为:一氧化碳和二氧化碳;CO2+Ca(OH)2═CaCO3↓+H2O;
(5)仪器②中装有碱石灰的干燥管的作用是:吸收空气中的二氧化碳;为验证装置①已将CO2吸收完全,可在装置①与②之间加入盛有澄清石灰水的洗气瓶;故答案为:①吸收空气中的二氧化碳;②盛有澄清石灰水的洗气瓶
③解:设二氧化锰样品中含有杂质炭的质量为x
C+O2
 CO2
CO212 44
x 1.1g
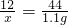 x=0.3g
x=0.3g样品中二氧化锰的质量分数=
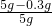 ×100%=94% 答:样品中二氧化锰的质量分数是94%
×100%=94% 答:样品中二氧化锰的质量分数是94% 故答案为:94%
分析:制取装置包括加热和不需加热两种,如果用双氧水制氧气就不需要加热,如果用高锰酸钾或氯酸钾制氧气就需要加热.氧气的密度比空气的密度大,不易溶于水,因此能用向上排空气法和排水法收集.若用F装置收集氧气,因为氧气的密度比空气的密度大,因此应该从长管进入;装置A、B都可以用来制取二氧化碳,比较这两个装置,A装置的优点是:可以随时控制反应的发生和停止.CO2气体中常含有HCl和水蒸气,要先除去氯化氢气体,再干燥;二氧化碳一般用澄清的石灰水来检验,一氧化碳用灼热的氧化铜来检验;有关的计算要准确.
点评:本考点主要考查气体的制取装置和收集装置的选择,同时也考查了化学方程式的书写和有关的计算,综合性比较强.书写化学方程式时,要注意配平,有关的计算要准确,本考点是中考的重要考点之一,主要出现在实验题和计算题中.

练习册系列答案
 应用题作业本系列答案
应用题作业本系列答案
相关题目