题目内容
![]() 【题目】如图所示,某兴趣小组在进行酸碱中和反应的实验探究时,向烧杯中氢氧化钠溶液中滴加稀盐酸一会儿后,发现忘记滴加指示剂。甲同学从烧杯中取少量反应后的溶液于一支试管中,并向试管中滴加几滴无色酚酞试液,振荡,观察到酚酞试液不变色。
【题目】如图所示,某兴趣小组在进行酸碱中和反应的实验探究时,向烧杯中氢氧化钠溶液中滴加稀盐酸一会儿后,发现忘记滴加指示剂。甲同学从烧杯中取少量反应后的溶液于一支试管中,并向试管中滴加几滴无色酚酞试液,振荡,观察到酚酞试液不变色。
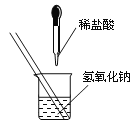
(1)猜想与假设:
【猜想一】甲同学:“两种物质已恰好完全中和,溶液呈中性”;
【猜想二】乙同学:“反应后氢氧化钠过量,溶液呈碱性”;
【猜想三】丙同学: 。
甲、丙两位同学经过讨论后觉得乙同学的猜想不正确,两位同学的理由是: 。
(2)设计并进行实验:
①为了验证自己的猜想,甲同学设计了以下实验方案:
实验步骤 | 实验现象 | 实验结论 |
用洁净干燥的玻璃棒蘸取少量反应后的溶液滴在干燥的pH试纸上,观察颜色变化并与标准比色卡对比。 | pH_______(填“>”、“=”或“<”)7 | 猜想一不成立 |
②请你设计另一个实验(与甲同学方案不同)方案,验证丙同学的猜想,并填写下表:
实验步骤 | 实验现象 | 实验结论 |
猜想三: ______________ (填“成立”或“不成立” ) |
【答案】(1)猜想三:两种物质反应后稀盐酸过量,溶液显酸性
理由是:若氢氧化钠有剩余,则反应后滴入无色酚酞溶液就不会出现无色的现象,而溶液会变红才对
(2)① <
②实验步骤:从烧杯中取出少量反应后的溶液于另一支试管中,用胶头滴管滴加1—2滴紫色石蕊溶液,振荡,观察现象(其他方案合理均正确,加入碳酸盐、加入活泼金属、加金属氧化物)
【解析】
试题分析:(1)猜想三:两种物质反应后稀盐酸过量,溶液显酸性
乙同学的猜想不正确,两位同学的理由理由是:若氢氧化钠有剩余,则反应后滴入无色酚酞溶液就不会出现无色的现象,而溶液会变红才对
(2)①根据恰好完全中和,溶液呈中性,那么此时溶液的PH=7,而两种物质反应后稀盐酸过量,溶液显酸性,则PH应小于7, 根据结论猜想一不成立,说明PH<7
②要验证丙同学的猜想,实际上就是证明溶液中含有盐酸,即抓住盐酸的化学性质,故实验步骤:从烧杯中取出少量反应后的溶液于另一支试管中,用胶头滴管滴加1—2滴紫色石蕊溶液,振荡,观察现象:若变红或不变红,则猜想三成立或不成立(其他方案合理均正确,加入碳酸盐、加入活泼金属、加金属氧化物)

 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案