题目内容
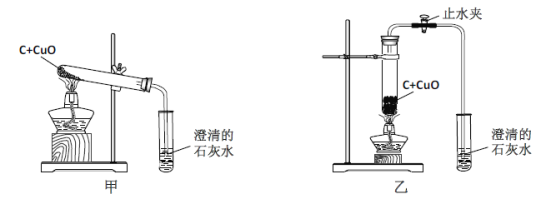
【题目】某白色固体可能是煅烧碳酸钙后的剩余物,为确定其成分,进行如下实验:

① 高温煅烧碳酸钙的化学方程式是 ;
② 分离B中难溶物的操作Ⅰ是 ;
③ 操作Ⅱ的目的是 ,D中白色固体可能是 ;
④ 为达到实验目的,还应进行的操作是 。
【答案】①CaCO3高温CaO+CO2↑ ②过滤
③检验原混合物中是否有氧化钙(C中是否有氢氧化钙) 碳酸钙
④取煅烧后的固体(或B中过滤后的固体),加入足量稀盐酸,产生气泡则剩余固体中含有碳酸钙
【解析】
试题分析:①高温煅烧碳酸钙的化学方程式是:CaCO3高温CaO+CO2↑
②过滤是将不溶性固体和液体进行分离,故分离B中难溶物的操作Ⅰ是:过滤
③根据经过操作II得到的现象:出现白色浑浊液,故可判断操作Ⅱ的目的是:检验原混合物中是否有氧化钙(C中是否有氢氧化钙);由于二氧化碳能使澄清石灰水变浑浊,原因是生成了不溶于水的碳酸钙,故D中白色固体可能是碳酸钙
④经过上面的探究,确定了煅烧碳酸钙后的剩余物中含有氧化钙,但是不是含有未分解完全的碳酸钙,并没有确定,故为达到实验目的,还应进行的操作是:取煅烧后的固体(或B中过滤后的固体),加入足量稀盐酸,产生气泡则剩余固体中含有碳酸钙

 阅读快车系列答案
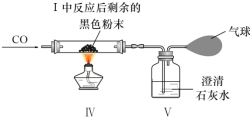
阅读快车系列答案【题目】为探究某干燥的绿色固体粉末的元素组成,某小组进行了如图所示的两个实验,请回答:
实验一 | 实验二 | |||||
|
| |||||
固体变 为黑色 | 白色变为蓝色 | 固体 减少 | 黑色变为 光亮红色 | 变 浑浊 | ||
① 装置Ⅱ中的现象说明装置Ⅰ中产生了 ;
② 装置Ⅳ中发生反应的化学方程式是 ;
③ 实验二中气球的作用是 ;
④ 实验二的步骤如下,其正确顺序是: ;
a、通一段时间的CO b、继续通CO c、熄灭酒精灯
d、待黑色变成光亮红色 e、停止通CO f、点燃酒精灯
⑤ 根据上述实验现象推知绿色固体的元素组成是 ;