��Ŀ����
����Ŀ��2016��10��17�գ��ҹ�����ʮһ�����˷ɴ�˳�����ա����������漰���ѧ֪ʶ������������и��⡣
��1�����ػ��ʹ�õ�ȼ��֮һΪƫ�����£�C2H8N2����ƫ��������̼���⡢��Ԫ�ص�������Ϊ________��
��2����ѧ��������������NiFe2O4��������Ա�����ķ���ת��Ϊ����Ա��Ҫ�����壬��������NiFe2O4����Ni��+2�ۣ���Fe�Ļ��ϼ�Ϊ_______��
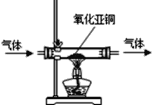
��3���Ա�����ʵ�����Ǹ���������С�ռ䣬��������ϵͳ�������Ա����������ϵͳ�ú��������ķ�������һ��װ�л���̿��������ȥ�к����壬��һ���������˻���̿��______���ã�ͬʱ��������ﮣ�LiOH�������ռ���ȥ������̼��������̼��﮺�ˮ���˷�Ӧ�Ļ�ѧ����ʽΪ___________________________��
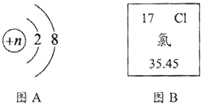
��4��̫���ܵ�ط����õ����黯�أ�GaAs������Ԫ����Ԫ�����ڱ�������ͼ��ʾ��Ϣ�������й�˵���������_____��������ĸ��ţ�
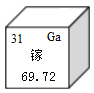
A�������ڽ���Ԫ�� B���ص�ԭ�Ӻ�����31������
C���ص����ԭ������Ϊ69.72 D���ص�ԭ�Ӻ�����31������
���𰸡� 6:2:7 +3 ���� 2LiOH + CO2 === Li2CO3 + H2O D
����������1�����ݻ������и�Ԫ��������=��ԭ�ӵ����ԭ��������ԭ�Ӹ���֮�ȣ����з������
��2�������ڻ��������������ϼ۴�����Ϊ�㣬���NiFe2O4�Ļ�ѧʽ���н�ɣ�
��3�����ݻ���̿�������ԡ���������������̼�ķ�Ӧ���д������ʽ��
��4������ͼ��Ԫ�����ڱ����Ի�õ���Ϣ�����Ͻǵ����ֱ�ʾԭ����������ĸ��ʾ��Ԫ�ص�Ԫ�ط��ţ��м�ĺ��ֱ�ʾԪ�����ƣ�������������ֱ�ʾ���ԭ�����������з����жϼ��ɡ�
�⣺��1�����ݻ������и�Ԫ��������=��Ԫ�ص����ԭ��������ԭ�Ӹ���֮�ȣ��ɵ�ƫ������C2H8N2��̼���⡢��Ԫ�ص�������Ϊ ��12��2����8����14��2��=6��2��7�����6��2��7��
��2��Ni�Ļ��ϼ�Ϊ+2�ۣ���Ԫ���ԩ�2�ۣ�����Ԫ�صĻ��ϼ���x�������ڻ��������������ϼ۴�����Ϊ�㣬�ɵã���+2��+x��2+����2����4=0����x=+3�ۣ����+3��
��3������̿���������ԣ���������ζ��ɫ�صȣ���ϵͳ�ú��������ķ�������һ��װ�л���̿��������ȥ�к����壬��һ���������˻���̿���������ã���������ﮣ�LiOH�������ռ���ȥ������̼��������̼��﮺�ˮ����Ӧ�Ļ�ѧ����ʽΪ��CO2+2LiOH�TLi2CO3+H2O�����������2LiOH+CO2�TLi2CO3+H2O��
��4��A����Ԫ�ش����ġ����ԣ����ڽ���Ԫ�أ���ѡ��˵����ȷ��
B������Ԫ�����ڱ��е�һ���֪�����Ͻǵ�����Ϊ31����ʾԭ������Ϊ31������ԭ������=�˵����=������=��������������Ԫ�ص�ԭ�ӵĺ��������Ϊ31����ѡ��˵����ȷ��
C������Ԫ�����ڱ��е�һ���֪��������������ֱ�ʾ���ԭ����������Ԫ�ص����ԭ������Ϊ69.72����ѡ��˵����ȷ��
D������Ԫ�����ڱ��е�һ���֪�����Ͻǵ�����Ϊ31����ʾԭ������Ϊ31������ԭ������=�˵����=������=��������������Ԫ�ص�ԭ�ӵĺ����������ͺ����������Ϊ31��������������Ϊ31����ѡ��˵������
��ѡ��D��

 ���Ŀ��ּ�����ҵ�����ҵ����������ϵ�д�
���Ŀ��ּ�����ҵ�����ҵ����������ϵ�д� ����ѵ��ϵ�д�
����ѵ��ϵ�д� ��ĩ�����ϵ�д�
��ĩ�����ϵ�д�����Ŀ�����ӡ�������𣿡���Ŀ����һ����Ƶ��������ֽ������һ����ͷ���м�խ��ֽ����Ȼ����ͷ�ֱ����ӵ�ص����������۲쵽����ֽ������ȼ�ա��ݴˣ�ijʵ��С��ͬѧȡij�֡���ֽ������������̽����
��1������ֽ��ȼ�յ�ԭ����ֽ�����˽�������������ɶ�·��ʹ����ֽ��ȼ�գ���ȼ�յ�������������ʼ����ֽ����ȼ�գ�����·��ȴ��ȼ�յ�ԭ�������� ��
��2��̽������ֽ���н����ijɷ֣�����ֽ���еĽ���������
���������ϡ��١���ֽ����������������ֽճ�϶��ɣ���п����һ�����ɫ���壻
�� ����Sn�����������Һ��Ӧ����+2�۵����Ρ�
��������롿�������ֽ���еĽ��������� �������ֽ���еĽ���������
������ʵ�顿��Ʒ���������ʵ�顣
ʵ����� | ʵ������ | ʵ���������� |
ȡ��ĥ��ġ���ֽ��Ƭ�����Թ��У��μ��Ȼ�п��Һ | ����ֽ�����������ɫ�������� | ����ʵ������Ͻ������˳���֪�������� �������������Ӧ�Ļ�ѧ����ʽΪ�� �� |
���������ۡ���ʵ���д�ĥ����ֽ����Ŀ�������� ��
���������ʵ���Һ����������Ȼ�п��Һ�������ʵ��������� ������ţ���
A���Ȼ�ͭ B�������� C�������� D����������
����˼Ӧ�á�
������·��������֣�����Ҫ�ϼӷ�������������Ż�Ӧ�ò�ȡ������ǣ� ��
��̽����չ����С��Ϊ�˲ⶨþͭ�Ͻ���þ������������ȡ��3g�Ͻ���Ʒ����60gϡ�����Ϊ6�ȷ����μ�����Ʒ�У���ַ�Ӧ����ˡ�ϴ�ӡ�������أ��õ���ʵ���������£�
ϡ�������� | ��1�� | ��2�� | ��3�� | ��4�� | ��5�� | ��6�� |
ʣ��������� | m | 2.0g | 1.5g | 1.0g | 0.6g | 0.6g |
��3��������m=���� ��
��4���Ͻ���Ʒ��þ������=���� ��
��5����������ϡ������H2SO4��������������Ҫ��д��������̣���ͬ��
��6�����㵱�����4��������Һ�ҳ�ַ�Ӧ��������Һ�����ʵ�����������