题目内容
【题目】Cu可以形成化合价为+2和+1的化合物,其中+l价化合物称为亚铜化合物。
(1)高温时,氧化铜可被木炭还原为铜,反应的化学方程式是__________。
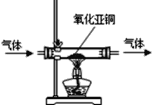
(2)氧化亚铜是一种红色粉末。加热时,氧化亚铜能与氧气发生化合反应,反应的化学方程式是________________________;利用这一性质可检验氮气中是否含有氧气(装置如图所示),判断氮气中含有氧气的现象是______________________________。
(3)三氧化二铁和氧化亚铜都是红色粉末,常用作颜料。
某校化学实验小组通过实验来探究一红色粉末是Fe2O3、Cu2O或二者混合物。探究过程如下:
【查阅资料】①Cu2O是一种碱性氧化物,溶于稀硫酸生成Cu和CuSO4,在空气中加热生成CuO
②Fe3+遇到KSCN试剂变红
【提出假设】 假设1:红色粉末是Fe2O3
假设2:红色粉末是Cu2O
假设3:红色粉末是Cu2O和Fe2O3的混合物
【设计探究实验】 取少量粉末放入足量稀硫酸中,在所得溶液中再滴加KSCN试剂。
①若假设1成立,则实验现象是______________。
②若假设2成立,写出反应的化学方程式:_____________。
【探究延伸】若经实验分析,确定红色粉末为Cu2O和Fe2O3的混合物。
实验小组欲用加热法测定Cu2O的质量分数。取a克固体粉末在空气中充分加热,待质量不在变化时,称其质量为b克(b>a),则混合物中Cu2O的质量分数为________________%。
【答案】 2CuO +O2 高温 2CuO + CO2↑ 2Cu2O +O2 加热 4CuO 红色粉末变成黑色 红色固体溶解,溶液变成黄色,加入KSCN试剂后溶液变红(答不全不得分) Cu2O +H2SO4= CuSO4 + Cu +H2O 900(b-a)/a 或 14400(b-a)/16a
【解析】(1)根据反应物是木炭和氧化铜、反应条件是高温、生成物是铜和二氧化碳写出木炭还原氧化铜的化学反应式,化学方程式为:C+2CuO ![]() 2Cu+CO2↑;
2Cu+CO2↑;
(2)根据题干信息加热时,氧化亚铜能与氧气发生化合反应,写出化学反应式并配平即可,所以化学反应式是:2Cu2O+O2 ![]() 4CuO;因红色氧化亚铜与氧气反应生成黑色氧化铜,而氮气一般不与其他物质反应,所以要检验氮气中是否含有氧气,可以用如图装置检验,当我们看到红色粉末变成黑色,说明有氧气;
4CuO;因红色氧化亚铜与氧气反应生成黑色氧化铜,而氮气一般不与其他物质反应,所以要检验氮气中是否含有氧气,可以用如图装置检验,当我们看到红色粉末变成黑色,说明有氧气;
(3)①若假设1成立,氧化铁与硫酸反应生成硫酸铁和水,红色固体溶解,溶液变成黄色, Fe2O3与稀硫酸反应生成Fe3+,遇到KSCN溶液呈红色,
②若假设2成立,氧化亚铜与硫酸反应生成硫酸铜、铜和水,化学方程式为:Cu2O +H2SO4= CuSO4 + Cu +H2O;
【探究延伸】依据题意,能发生反应的物质为Cu2O,最后变成CuO,增加的质量就是反应的氧气的质量,根据质量差计算可以得出Cu2O的质量分数;
设样品中氧化亚铜的质量为m,
2Cu2O+O2═4CuO △m
288g 32g
m (b-a)g
m=9(b-a)g
则混合物中Cu2O的质量分数为![]() =
=![]() %。
%。