题目内容
【题目】写出下列反应的化学式表达式(例如:氢气在氧气中燃烧,H2 + O2![]() H2O)。
H2O)。
(1)碳酸不稳定分解_____
(2)加热碳酸氢铵 _____
(3)铜在空气中加热变黑______
(4)二氧化碳通入澄清石灰水_______
【答案】【答题空1】H2CO3![]() H2O +CO2 【答题空2】NH4HCO3
H2O +CO2 【答题空2】NH4HCO3![]() NH3 + H2O + CO2 【答题空3】Cu +O2
NH3 + H2O + CO2 【答题空3】Cu +O2![]() CuO 【答题空4】CO2 + Ca(OH)2
CuO 【答题空4】CO2 + Ca(OH)2![]() CaCO3 + H2O
CaCO3 + H2O
【解析】
(1)碳酸不稳定分解生成二氧化碳和水,反应的化学式表达式为: H2CO3![]() H2O +CO2;
H2O +CO2;
(2)加热碳酸氢铵生成氨气、水和二氧化碳,反应的化学式表达式为: NH4HCO3![]() NH3 + H2O + CO2;
NH3 + H2O + CO2;
(3)铜在空气中加热生成氧化铜,反应的化学式表达式为:Cu +O2![]() CuO;
CuO;
(4)二氧化碳通入澄清石灰水生成碳酸钙和水,反应的化学式表达式为:CO2 + Ca(OH)2![]() CaCO3 + H2O。
CaCO3 + H2O。

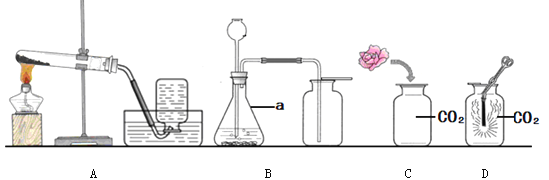
【题目】某研究小组对过氧化氢溶液制取氧气进行如下探究:
实验一:如图装置可用于多次连续进行氧气的制取和性质的实验。
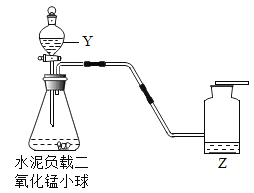
(1)仪器Y的名称是_______。
(2)该反应的化学式表达式:________,二氧化锰在反应中的作用是___。多孔水泥负载二氧化锰小球用于实验时的主要优点是_____,检验氧气已收集满的方法_________。
(3)做氧气的性质实验时,实验不同,Z的作用不同。
①铁丝燃烧。Z为水,其作用是_____。
②蜡烛燃烧。Z为______,其作用是验证蜡烛燃烧生成了二氧化碳。
实验二:探究H2O2质量分数、溶液pH、温度对反应速率的影响
(2)设计如下表实验方案:
实验序号 | H2O2质量分数/% | pH | 温度/℃ | 每分钟气泡数 |
1 | 30 | 5 | 20 | |
2 | 30 | 6 | 20 | |
3 | 30 | 11 | 20 | |
4 | 15 | 11 | 30 | |
5 | a | 11 | b |
①进行实验1~3的目的是探究________。
②a=_________;b=_________。
实验三:探究制取氧气的适宜催化剂

(3)实验方案如下:
I.用MnO2、CuO、Fe2O3、Cr2O3四种催化剂分别与海藻酸钠溶液混合,滴入氯化钙溶液制成含等质量催化剂、大小相同的海藻酸钠微球,备用。
II.取30粒含MnO2的海藻酸钠微球,采用左下图装置进行实验。改用其他三种微球,分别重复上述实验,得到右下图的锥形瓶内压强随时间变化的曲线图。
①每次实验时,海藻酸钠微球数应相同的原因_________。
②用含MnO2的海藻酸钠微球进行实验,60s时压强瞬间回落,其原因是____。
③从实验曲线看,催化效果较好、反应温和的催化剂是______。