题目内容
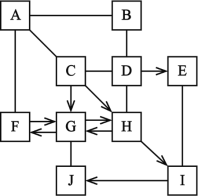
【题目】如图甲、乙两种固体物质(均不含结晶水)的溶解度曲线,下列说法正确的是( )
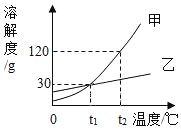
A. t1℃时中甲、乙饱和溶液中溶质的质量相等
B. t2℃时等质量的甲、乙饱和溶液降温到t1℃时,所得两种溶液中溶剂的质量相等
C. 若甲中含有少量乙,可以用蒸发溶剂的方法提取乙
D. t2℃时110g甲的饱和溶液,降温并加入一定质量的水可以得到260g t1℃时甲的饱和溶液
【答案】D
【解析】
A、据图可以看出,t1℃时甲、乙溶解度相同,饱和溶液中溶质的质量分数相等,溶质质量不一定相等,故A错误;
B、t2℃时甲的溶解度大于乙的溶解度,等质量的甲、乙饱和溶液,甲中含有的溶剂少,降温到t1℃时,溶剂的质量不变,所得两种溶液中溶剂的质量不相等,错误;
C、由于甲的溶解度随温度的变化较大,乙的溶解度随温度的升高变化较小,故甲物质中混有少量乙物质,应采用冷却热饱和溶液的方法提纯,错误;
D、t2℃时110g甲的饱和溶液,降温并加入一定质量的水可以得到260gt1℃时甲的饱和溶液,正确。
故选:D。

【题目】下表是NaCl、KNO3在不同温度时的溶解度,根据数据回答。
温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 | 60 | |
溶解度 | NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 |
(g/100g水) | KNO3 | 13.3 | 20.9 | 31.6 | 45.8 | 63.9 | 85.5 | 110 |
①氯化钠的溶解度受温度变化的影响_____(填“很大”或“很小”)。
②50℃时,KNO3的溶解度_____(填“<”、“>”或“=”)NaCl的溶解度;向烧杯中加入100g水和49.0gKNO3固体配成50℃的溶液,再冷却到20℃,烧杯中析出固体的质量为_____g。
③KNO3中混有少量的NaCl,提纯的方法是_____(填“降温结晶”或“蒸发结晶”)。
④要比较NaCl和KNO3在水中的溶解性强弱,测定的数据可以是:相同温度下,等质量的溶质完全溶解达到饱和时所需水的质量;或_____。
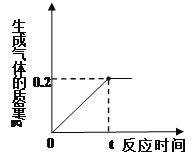
⑤如图是有关硝酸钾溶液的实验操作及变化情况,说法正确的是_____(填编号)。
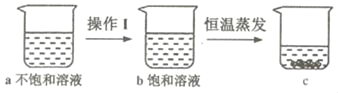
A 操作I一定是降温
B a与b的溶剂质量可能相等
C a与c的溶质质量一定相等
D b与c的溶质质量分数一定相等
【题目】银白色的金属钠是化学实验室中常见的药品,其化学性质十分活泼。某化学兴趣小组的同学,进行如下探究活动。
[查阅资料]
将一小块银白色的金属钠放置在空气中会发生下列变化:
钠![]() 钠的氧化物
钠的氧化物![]() 氢氧化钠溶液
氢氧化钠溶液![]() 白色固体
白色固体
[查阅资料]
A.钠的氧化物有氧化钠(Na2O)和过氧化钠(Na2O2),都能与水反应,反应化学方程式
如:Na2O+H2O=2NaOH;2Na2O2+2H2O=4NaOH+O2↑
B.CaCl2溶液呈中性;碳酸钠溶液能与CaCl2溶液发生复分解反应;
C.碳酸钠溶液与盐酸反应方程式有:
Na2CO3 +HCl=NaHCO3 +NaCl(盐酸量不足)
Na2CO3+2HCl=2NaCl+H2O+CO2↑(盐酸量过量)
探究一:钠的氧化物是Na2O还是Na2O2 ?
(1)为检验常温下钠与氧气反应的产物,是Na2O还是Na2O2,完成实验方案:
选取试剂 | 实验现象 | 实验结论 |
__________ | __________ | 产物为Na2O |
探究二:白色固体是NaOH还是Na2CO3 ?
(2) 钠在空气中放置一段时间得到白色固体的成分
猜想1:Na2CO3 猜想2:NaOH 猜想3:Na2CO3和NaOH
[实验1] 取少量白色固体加水配成溶液,再滴入几滴稀盐酸,无气泡产生。
化学小组认为:据此现象,还不能得出猜想2成立。理由是________________。
[实验2] 化学小组进行如下实验
实验操作 | 实验现象 | 实验结论 |
①取少量白色固体配成溶液,加入足量______ | __________ | 猜想3成立 |
②过滤,取少量滤液滴入___________ | __________ |
【题目】煅烧石灰石(主要成分 CaCO3)生成生石灰(CaO)和二氧化碳。为了测定某石灰石中碳酸钙(CaCO3)的含量,现称取 24.0g 石灰石样品,进行四次高温煅烧、冷却,称量剩余固体的质量 (杂质不参加反应),记录实验数据如下:
操作 | 第一次 | 第二次 | 第三次 | 第四次 |
剩余固体质量 | 21.6g | 19.2g | 15.2g | 15.2g |
试计算:
(1)完全反应后生成二氧化碳的质量为_____;
(2)求该石灰石样品中碳酸钙的质量_____。