题目内容
33、已知一种固体化合物由氢、氧、碳、铜四种元素组成,向盛有该化合物的试管中加入稀盐酸时,固体逐渐溶解,有大量气泡产生,得到蓝绿色的氯化铜溶液.
(1)探究产生的气体是什么.
猜想:①可能是氢气;②
实验:请针对你②和③猜想中的一种,设计实验方案,验证你的猜想
(2)从蓝绿色溶液中提取金属铜.有关实验方案如下:
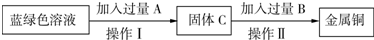
①操作Ⅰ的名称为
②操作II中加入足量B的目的是
(1)探究产生的气体是什么.
猜想:①可能是氢气;②
可能是O2;
;③可能是CO2
…实验:请针对你②和③猜想中的一种,设计实验方案,验证你的猜想
用带火星木条试验,木条复燃.(或将气体通入石灰水,石灰水变浑浊等)
.(2)从蓝绿色溶液中提取金属铜.有关实验方案如下:

①操作Ⅰ的名称为
过滤
;加入过量A的目的是使溶液中的氯化铜完全反应
;有关反应的化学方程式为Fe+CuCl2═FeCl2+Cu(或Zn+CuCl2═ZnCl2+Cu等)
.②操作II中加入足量B的目的是
完全除去过量的A
;确定此目的已经达到的依据是溶液中不再有气泡产生,则说明目的已经达到
.分析:(1)根据反应前后元素的种类不变分析解答;
(2)在金属活动性顺序中,只有排在氢前面的金属才可以和稀酸溶液反应生成氢气,只有活泼的金属才可以把排在它后面的金属从盐溶液中置换出来,因此为从蓝绿色溶液中提取金属铜,应该加入一种金属活动性比铜强的金属;从题意可知,由于加入的这种金属是过量,也就是我们得到的铜中混有这种过量的金属,而铜在氢后,不和稀酸溶液反应,因此加入酸溶液可以除去过量的这种金属,得到纯净的铜.
(2)在金属活动性顺序中,只有排在氢前面的金属才可以和稀酸溶液反应生成氢气,只有活泼的金属才可以把排在它后面的金属从盐溶液中置换出来,因此为从蓝绿色溶液中提取金属铜,应该加入一种金属活动性比铜强的金属;从题意可知,由于加入的这种金属是过量,也就是我们得到的铜中混有这种过量的金属,而铜在氢后,不和稀酸溶液反应,因此加入酸溶液可以除去过量的这种金属,得到纯净的铜.
解答:解:(1)根据元素的种类在化学反应前后不变,因此生成的气体可能是氧气、氢气、二氧化碳、一氧化碳或者是甲烷等,故答案为:氧气,二氧化碳(合理即可).
检验氧气可以用带火星的木条试验,木条复燃,证明是氧气;(合理即可).
(2)①由于为从氯化铜溶液中得到铜,应在溶液中加入一种排在铜前的金属,如:铁或锌等,加入金属后,完全反应后就得到了金属固体和新的溶液,为了把金属和溶液分开,因此应该采取过滤的方法,为了把铜全部从溶液中置换出来,加入的金属应该是过量的;故答案为:过滤;使溶液中的氯化铜完全反应,Fe+CuCl2═FeCl2+Cu(合理即可).
②由于加入的金属是过量的,为了把过量的金属铁或者是锌除去应该加入稀酸溶液,故答案为:完全除去过量的A;溶液中不再有气泡产生,则说明目的已经达到.
故答案为:(1)猜想:O2; CO2(或CO、CH4等)
实验:用带火星木条试验,木条复燃.(或将气体通入石灰水,石灰水变浑浊等)
(2)①过滤; 使溶液中的氯化铜完全反应;
Fe+CuCl2=FeCl2+Cu(或Zn+CuCl2=ZnCl2+Cu等)
②使过量的A完全除去; 溶液中不再有气泡产生,则说明目的已经达到.
检验氧气可以用带火星的木条试验,木条复燃,证明是氧气;(合理即可).
(2)①由于为从氯化铜溶液中得到铜,应在溶液中加入一种排在铜前的金属,如:铁或锌等,加入金属后,完全反应后就得到了金属固体和新的溶液,为了把金属和溶液分开,因此应该采取过滤的方法,为了把铜全部从溶液中置换出来,加入的金属应该是过量的;故答案为:过滤;使溶液中的氯化铜完全反应,Fe+CuCl2═FeCl2+Cu(合理即可).
②由于加入的金属是过量的,为了把过量的金属铁或者是锌除去应该加入稀酸溶液,故答案为:完全除去过量的A;溶液中不再有气泡产生,则说明目的已经达到.
故答案为:(1)猜想:O2; CO2(或CO、CH4等)
实验:用带火星木条试验,木条复燃.(或将气体通入石灰水,石灰水变浑浊等)
(2)①过滤; 使溶液中的氯化铜完全反应;
Fe+CuCl2=FeCl2+Cu(或Zn+CuCl2=ZnCl2+Cu等)
②使过量的A完全除去; 溶液中不再有气泡产生,则说明目的已经达到.
点评:科学探究题是初中化学试题中常见但却十分重要的一类题型,在处理此类前后答案相互影响的问题时,注意通读全题,避免因前面的回答给后面解决问题制造许多困难.

练习册系列答案
相关题目



