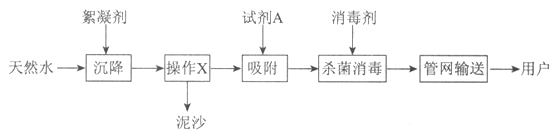
题目内容
【题目】(1)实验室需用100g20%的KNO3溶液,现提供如图所示的足量药品。仔细观察,认真设计将配制溶液的方案及所需的各种药品用量填空。
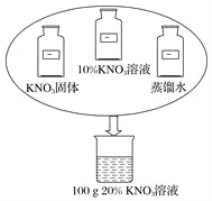
方案一:将10%的KNO3溶液蒸发水分需10%的KNO3溶液_____g。
方案二:__________。
(2)配制溶质质量分数一定的溶液时,正确的操作顺序是_____。
【答案】200 用KNO3固体和蒸馏水来配制该溶液,需KNO3固体20g,需蒸馏水80g 计算,称量(或量取),溶解(或稀释),装瓶存放
【解析】
(1)方案一:解法一(经验)“蒸发溶液质量一半的水,可使溶液的质量分数增加一倍”即取200 g 10%的硝酸钾溶液蒸发掉100 g水。
解法二:设需10%的KNO3溶液的质量为x,根据溶质的关系:100×20%=x×10%,可得x=200 g。
方案二:100 g 20%的溶液中溶质的量为100 g×20%=20g,溶剂的量100 g-20g=80 g。
(2)若使用固体物质溶解配制溶液时,配制溶液的操作过程为计算-称量-溶解;若采取加水稀释的方法配制溶液,配制溶液的操作过程为计算-量取-溶解;完全溶解后贴上标签装瓶保存;因此操作顺序为计算,称量(或量取),溶解(或稀释),装瓶存放。

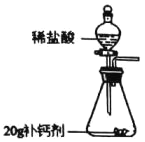
【题目】在一支试管中放入一小段镁条(已擦去氧化膜),再向试管中加入一定量的盐酸,镁条表面有________产生,反应的化学方程式是________________________________________________________。
[发现问题]为了再次观察上述反应现象,小林同学用较长的镁条重做上述实验,但发现了异常现象,试管中出现了白色沉淀。
[实验验证1]小林同学针对两次实验的不同,设计对比实验方案,探究出现异常现象的原因。
试管(盛有同体积同浓度的盐酸) | ① | ② | ③ | ④ |
镁条长度 | 1cm | 2cm | 3cm | 4cm |
相同的实验现象(省略题干现象) | 快速反应,试管发热,镁条全部消失 | |||
沉淀量差异(恢复至20℃) | 无 | 少量 | 较多 | 很多 |
[得出结论]镁条与盐酸反应产生白色沉淀与________有关。
[追问]白色沉淀是什么物质?
[查阅资料]①20 ℃时,100 g水中最多能溶解氯化镁54.8 g;
②镁能与热水反应产生一种碱和氢气;
③氯化银既不溶于水也不溶于稀硝酸。
[做出猜想]猜想一:镁;猜想二:氯化镁;猜想三:氢氧化镁,猜想的依据是____________________(用化学方程式表示)。
[实验验证2]将白色沉淀洗涤干净,分别取少量沉淀于A、B、C试管中,进行如表实验:
试管 | 操作 | 现象 | 结论 |
A | 加入足量盐酸 | ________,白色沉淀________ | 猜想一不正确,但这种白色沉淀能溶于盐酸 |
B | 加入足量水 | 白色沉淀________ | 猜想二不正确 |
C | 加入适量稀硝酸 | 白色沉淀消失 | 原白色沉淀中含有的离子是: |
继续滴加几滴硝酸银溶液 | 出现大量白色沉淀 |
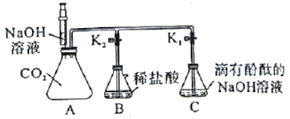
【题目】化学兴趣小组的同学按图示装置及步骤验证氢氧化钠的化学性质。
(实验步骤)
I.将注射器内的液体注入A中的锥形瓶。
II.打开K1,观察到C中部分红色溶液沿导管倒吸入A,片刻后回流停止。
III.打开K2,观察到B中溶液倒吸入A、C中,液面稳定后观察到A中溶液仍为红色,C中溶液变为无色。
同学们对相关问题分组展开如下探究。
探究环节 | 甲组的探究 | 乙组的探究 |
[提出问题] | A中使酚酞变为红色的物质是什么? | C中溶液为什么变成无色? |
[做出猜想] | 猜想一:Na2CO3 猜想二:Na2CO3和NaOH | 猜想一:实验过程中酚酞变质了 猜想二:溶液中的NaOH反应完了 |
[实验验证] | 小鹏取少量A中溶液于试管中,向其中滴加过量BaCl2溶液,若观察到______,证明猜想二成立。小丽认为用Ba(OH)2溶液也可证明猜想二成立,小鹏认为小丽的方案不合理,理由是_______。 | (1)取少量C中溶液于试管中,向其中滴加NaOH溶液.溶液又变为红色,证明猜想一不成立。 (2)用pH试纸测定C中溶液的酸碱度,若pH___7,证明猜想二成立。 |
(反思交流)(1)甲、乙两组同学的实验证明了NaOH能与稀盐酸、CO2发生反应;A中溶液里一定还存在NaCl。写出NaOH与CO2发生反应的化学方程式_________。
(2)[实验步骤]中的现象_____(填“能”或“不能”)证明NaOH与CO2发生了反应。
(拓展迁移)对于无明显现象的化学反应,可通过检验有新物质生成或检验_____的方法来证明反应发生了。