题目内容
【题目】普通黄铜仅由铜和锌组成,广泛用于制造板材、管材等,也用于铸造机械零件。为测定黄铜中铜的质量分数,取样品10 g,分四次向其中加入稀硫酸使之充分反应,实验数据记录如下表:
第一次 | 第二次 | 第三次 | 第四次 | |
加入稀硫酸的质量/g | 10 | 10 | 10 | 10 |
剩余固体的质量/g | 8.7 | 7.4 | 7 | 7 |
认真分析数据,回答下列问题:
(1)该过程中发生反应的化学方程式为_____。
(2)黄铜中铜的质量分数为_____。
(3)加入的稀硫酸溶液中纯硫酸的质量是_____。(写出计算过程)
【答案】![]() 70% 7.84g
70% 7.84g
【解析】
根据化学方程式的计算及表格信息分析解答。
(1)黄铜仅由铜和锌组成,且Cu的金属活动性弱于H,Zn的金属活动性强于H,故只有Zn能与稀硫酸反应,其反应方程式为![]() 。
。
(2)根据表格数据可知最终剩余固体为7g,故10g黄铜样品中铜的质量为7g,其质量分数为![]() 。
。
(3)分析表格数据可知,第一组实验中稀硫酸反应完,消耗的Zn质量为10g-8.7g=1.3g。
设10g稀硫酸中含H2SO4的质量为x。
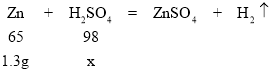
![]() ,x=1.96g,
,x=1.96g,
故10g稀硫酸中含纯硫酸1.96g,则40g稀硫酸中含纯硫酸为![]() ;
;
答:加入的稀硫酸溶液中纯硫酸的质量是7.84g。

练习册系列答案
相关题目