题目内容
(2011?怀柔区二模)为测定实验室一瓶放置已久的烧碱中NaOH含量,取50g的烧碱样品,溶于一定量的水得到200g溶液;再加入200g稀盐酸(足量)充分搅拌到不再放出气泡为止,称量溶液为395.6g.计算:(1)反应产生的CO2的质量为______g.
(2)样品中NaOH的质量分数是多少?
【答案】分析:根据题意可知,生成CO2的质量就是溶液减少的质量.然后根据CO2的质量就可以求出烧碱变质后生成碳酸钠的质量,用烧碱样品的质量减去碳酸钠的质量就是样品中NaOH的质量,根据公式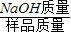 ×100%即可就出其质量分数.
×100%即可就出其质量分数.
解答:解:根据题意得:反应后生成CO2的质量为:200g+200g-395.6g=4.4g.
设样品中Na2CO3的质量为x
Na2CO3+2HCl=2NaCl+H2O+CO2↑
106 44
x 4.4g
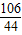 =
=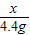
x=10.6g
则样品中NaOH的质量为:50g-10.6g=39.4g
样品中NaOH的质量分数为: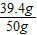 ×100%=78.8%
×100%=78.8%
答:1、反应生成CO2的质量为4.4g.
2、样品中NaOH的质量分数为78.8%.
点评:在该类型的化学计算题中溶液减少的质量就是生成气体的质量.将气体的质量带入化学方程式计算.然后根据题目的数量关系就可以得出正确答案.
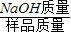 ×100%即可就出其质量分数.
×100%即可就出其质量分数.解答:解:根据题意得:反应后生成CO2的质量为:200g+200g-395.6g=4.4g.
设样品中Na2CO3的质量为x
Na2CO3+2HCl=2NaCl+H2O+CO2↑
106 44
x 4.4g
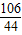 =
=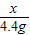
x=10.6g
则样品中NaOH的质量为:50g-10.6g=39.4g
样品中NaOH的质量分数为:
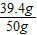 ×100%=78.8%
×100%=78.8%答:1、反应生成CO2的质量为4.4g.
2、样品中NaOH的质量分数为78.8%.
点评:在该类型的化学计算题中溶液减少的质量就是生成气体的质量.将气体的质量带入化学方程式计算.然后根据题目的数量关系就可以得出正确答案.

练习册系列答案
相关题目
(2011?怀柔区二模)有一包白色的固体粉末,可能是NaHCO3、NaOH中的一种或二种,化学小组对其组成进行如图所示的实验:
资料:1.酒精灯加热温度约500~600℃.
2.NaOH 318.4℃熔化不分解,1390℃沸腾不分解.
3.Na2CO3+CaCl2→CaCO3↓+2NaCl.
4.Na2CO3溶液呈碱性;CaCl2溶液呈中性
(1)完成实验报告的内容:
Na2CO3+H2O+CO2↑
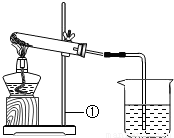
资料:1.酒精灯加热温度约500~600℃.
2.NaOH 318.4℃熔化不分解,1390℃沸腾不分解.
3.Na2CO3+CaCl2→CaCO3↓+2NaCl.
4.Na2CO3溶液呈碱性;CaCl2溶液呈中性
(1)完成实验报告的内容:
| 实验操作 | 实验现象 | 实验结论 |
| ①取一定量的白色粉末加热,将产生的气体通入小烧杯中,至无气体产生时,停止加热 (小烧杯内盛有澄清的石灰水) | 试管内壁有无色液滴,石灰水变浑浊,试管内剩余白色固体物质 | 粉末中一定含有 ______ 反应的化学方程式是 ______ |


