题目内容
【题目】84消毒液的有效成分是次氯酸钠(NaClO),次氯酸钠工业制法的反应原理是: ![]() 。某同学将Cl2通入185.8 g NaOH溶液中(NaOH过量),充分反应后得到混合溶液200g。计算:(计算结果精确到0.1%)
。某同学将Cl2通入185.8 g NaOH溶液中(NaOH过量),充分反应后得到混合溶液200g。计算:(计算结果精确到0.1%)
(1)参加反应的氯气质量是多少g。
(2)混合溶液中次氯酸钠的质量分数。
(3)84消毒液中起消毒作用的是次氯酸钠中的氯元素。已知某品牌84消毒液中起消毒作用的氯元素质量分数为6%,计算该84消毒液中次氯酸钠的质量分数。
【答案】14.2g;7.45%;12.6%
【解析】
(1)氢氧化钠溶液过量说明通入的氯气全部被反应,所以由质量守恒定律可得参加反应的氯气质量=反应后溶液质量-反应前溶液质量=200g-185.8g=14.2g;
(2)解:设次氯酸钠的质量分数为x
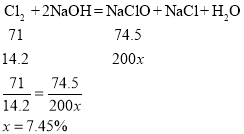
故次氯酸钠的质量分数为7.45%
(3)解:设次氯酸钠的质量分数为x

故次氯酸钠的质量分数为12.6%

练习册系列答案
 新编小学单元自测题系列答案
新编小学单元自测题系列答案
相关题目
【题目】氯化钠、碳酸钠、硝酸钾在不同温度时的溶解度如下表所示,某同学根据表中数据作出了其中一种物质的溶解度曲线(如下图所示),请根据表和图中信息填空。
| 0 | 10 | 20 | 30 | 40 |
氯化钠 | 35.7 | 35.8 | 36 | 36.5 | 37 |
碳酸钠 | 6 | 16 | 18 | 36.5 | 50 |
硝酸钾 | 13.3 | 20.9 | 31.6 | 45.8 | 63.9 |

(1)曲线M是表中_____的溶解度曲线,该物质在5℃时的溶解度约为___g。
(2)如果将表中三种物质的溶解度曲线全部画出,在0℃~40°C范围内会有_____个两线交点。
(3)10℃时,将15g氯化钠和15g硝酸钾固体同时加入盛有50g水的烧杯中,充分搅拌、溶解、静置后,烧杯底部剩余的固体是_________。