题目内容
【题目】在一烧杯中盛有由Na2CO3和NaCl 组成的固体混合物25g,向其中逐渐滴加溶质质量分数为10%的稀盐酸,放出气体的质量与滴入稀盐酸的质量关系如图所示(已知反应的化学方程式为:Na2CO3+2HCl=2NaCl+CO2↑+H2O)。请分析曲线图后回答下列问题:

(1)当滴加稀盐酸至图中A点时,烧杯中溶液的pH_______7(填“>”或“=”或“<”),溶液中的溶质为___________(填化学式)。当滴加稀盐酸至图中B点时,烧杯中溶液的pH______7(填 “>”或“=”或“<”)。
(2)A点时消耗溶质HCl的质量为______g,放出CO2的质量_____g。B点放出CO2的质量为______ g。
(3)计算原固体混合物中氯化钠的质量分数______。
【答案】 = NaCl < 7.3 4.4 4.4 设滴加稀盐酸到A时,参加反应的碳酸钠的质量为X,由题意可知,当滴加到A时,
Na2CO3+2HCl═2NaCl+H2O+CO2↑
106 73
X 7.3g
X═10.6g
所以混合物中氯化钠的质量为25g-10.6g═14.4g
混合物中氯化钠的质量分数为14.4g/25g×100%==57.6%
【解析】由题中信息知,(1)当滴加稀盐酸至图中A点时,烧杯中溶液的pH = 7,溶液呈中性,溶液中的溶质为NaCl。当滴加稀盐酸至图中B点时,烧杯中溶液的pH<7,此时盐酸过量,溶液呈酸性。﹙2) A点时消耗溶质HCl的质量为73g×10%=7.3g. 解∶设放出CO2的质量为xg
Na2CO3+2HCl=2NaCl+CO2↑+H2O
73 44
7.3g x
![]() =
=![]() , x=4.4g. 放出CO2的质量4.4g。B点放出CO2的质量为4.4g。
, x=4.4g. 放出CO2的质量4.4g。B点放出CO2的质量为4.4g。
(3)计算原固体混合物中氯化钠的质量分数∶
解∶设原固体混合物中碳酸钠的质量为xg
Na2CO3+2HCl═2NaCl+H2O+CO2↑
106 73
X 7.3g
![]() =
=![]() ,x=10.6g
,x=10.6g
混合物中氯化钠的质量为25g-10.6g═14.4g
原固体混合物中氯化钠的质量分数∶![]() ×100%=57.6%.
×100%=57.6%.
答∶原固体混合物中氯化钠的质量分数是57.6%.
点睛∶本题是一道综合题,主要考查pH的应用以及根据化学方程式进行计算。

 名校课堂系列答案
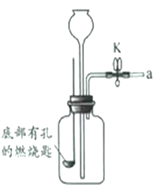
名校课堂系列答案【题目】利用表中装置进行下列实验。已知:白磷的着火点为40℃。
实验装置 | 实验1 | 实验2 |
| I.将盛有足量锌粒的燃烧匙伸入瓶中,塞紧瓶塞 | I.将盛有白磷的燃烧匙伸入瓶内,塞紧瓶塞 |
(1)连接仪器后,关闭K,加水至长颈漏斗内液面高于瓶中液面。一段时间后,液面高度保持不变,该现象说明 。
(2)实验Ⅰ中,瓶内发生反应的化学方程式为 ;步骤Ⅲ中,关闭K后的现象是 。
(3)实验2中,仅对比步骤Ⅱ和Ⅲ可知,欲探究的燃烧条件是 。