题目内容
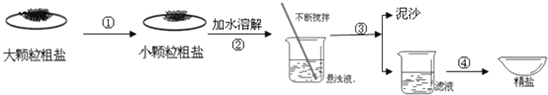
【题目】已知某粗盐样品中含有少量MgCl2、CaCl2及不溶性杂质(杂质不与试剂反应)。某兴趣小组设计了如下实验流程对该粗盐进行提纯并计算产率,请根据图示回答下列问题:
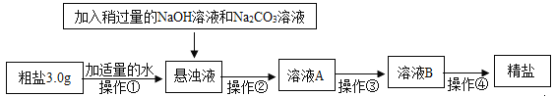
(1)操作②是进行过滤,其目的是为了除去样品中不溶性杂质及生成的Mg(OH)2和_____(填化学式)。若在过滤后发现溶液A仍浑浊,应采取的措施是_____。
(2)操作③是在加热条件下不断滴加适量的稀盐酸,调节溶液的pH等于7,该操作的目的是为了_____,写出其中一个反应的化学方程式为_____。
(3)操作④是将溶液B倒入蒸发皿中,加热并不断搅拌,直到蒸发皿中出现_____时(填现象),停止加热,加热过程中不断搅拌的目的是:_____。
(4)若过滤时滤纸有破损,会使测得的产率_____(填“偏高”、“偏低”、“无影响”,下同);粗盐样品中含有的MgCl2、CaCl2会使测得的产率_____。
【答案】CaCO3 再过滤 除去过量的Na2CO3和NaOH NaOH+HCl=NaCl+H2O(或Na2CO3+2HCl=2NaCl+CO2↑+H2O) 较多固体 防止液滴飞溅 偏高 偏高
【解析】
粗盐样品中含有少量MgCl2、CaCl2及不溶性杂质,溶解后加入稍过量的NaOH溶液和Na2CO3溶液,MgCl2和NaOH反应生成Mg(OH)2沉淀,CaCl2和Na2CO3反应生成CaCO3沉淀,过滤之后,在加热条件下不断滴加适量稀盐酸,调节溶液的pH等于7,除去过量的NaOH和Na2CO3,再经过蒸发结晶得到精盐。
(1)根据分析可知,操作②是过滤,目的是为了除去样品中不溶性杂质及生成的Mg(OH)2和CaCO3;若在过滤后发现溶液A仍浑浊,需要再次过滤;
(2)操作③是在加热条件下不断滴加适量的稀盐酸,调节溶液的pH等于7,该操作的目的是为了除去过量的Na2CO3和NaOH,化学方程式为:NaOH+HCl=NaCl+H2O,Na2CO3+2HCl=2NaCl+CO2↑+H2O;
(3)操作④是蒸发结晶,将溶液B倒入蒸发皿中,加热并不断搅拌,直到蒸发皿中出现较多固体时,停止加热,加热过程中不断搅拌是防止液滴飞溅;
(4)若过滤时滤纸有破损,会使少量沉淀进入溶液,使测得的产率偏高;粗盐样品中含有的MgCl2、CaCl2最终都会转化为NaCl,使测得的产率偏高。

【题目】如表是氯化钠和硝酸钾在不同温度下的溶解度,请回答
温度/℃ | 0 | 20 | 40 | 60 | |
溶解度/g | NaCl | 35.7 | 36.0 | 36.6 | 37.3 |
KNO3 | 13.3 | 31.6 | 63.9 | 110 | |
(1)20℃时,100g水中最多可以溶解__g氯化钠.
(2)要使接近饱和的硝酸钾溶液变为饱和溶液,可采取的方法是__(写1种).
(3)60℃时,KNO3饱和溶液的溶质质量分数为__(精确到0.1%).
(4)请在如图坐标系中,用光滑的曲线绘制硝酸钾的溶解度曲线__.