题目内容
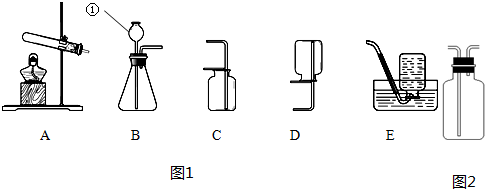
根据图1回答问题.
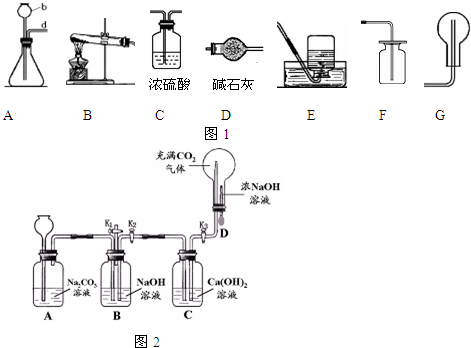
(1)写出仪器的名称:b
(2)实验室制取二氧化碳的化学方程式是
(3)氨气是一种无色、有刺激性气味的气体,极易溶于水,氨水显碱性.实验室用加热氯化铵和熟石灰两种固体的混合物来制取氨气,实验室制取氨气的发生、干燥、收集装置应分别选用(填序号)
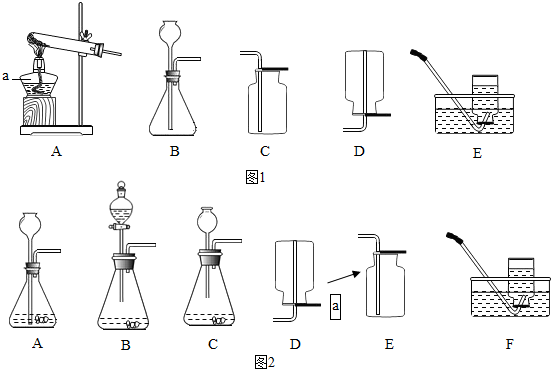
(4)某化学兴趣小组设计了如图2所示实验装置,进行了以下实验.
①先打开K1,关闭K2和K3,从长颈漏斗向A 中加入足量的稀盐酸.此时装置B中发生反应的化学方程式为
②然后关闭K1和 K3,打开K2,将胶头滴管中的浓氢氧化钠溶液挤入锥形瓶中.稍后打开K3,此时装置C和D中的现象分别是

(1)写出仪器的名称:b
长颈漏斗
长颈漏斗
.(2)实验室制取二氧化碳的化学方程式是
CaCO3+2HCl═CaCl2+CO2↑+H2O
CaCO3+2HCl═CaCl2+CO2↑+H2O
,发生装置和气体的收集装置是AF
AF
(填装置序号,下同)(3)氨气是一种无色、有刺激性气味的气体,极易溶于水,氨水显碱性.实验室用加热氯化铵和熟石灰两种固体的混合物来制取氨气,实验室制取氨气的发生、干燥、收集装置应分别选用(填序号)
B
B
、D
D
、G
G
.(4)某化学兴趣小组设计了如图2所示实验装置,进行了以下实验.
①先打开K1,关闭K2和K3,从长颈漏斗向A 中加入足量的稀盐酸.此时装置B中发生反应的化学方程式为
CO2+2NaOH═Na2CO3+H2O
CO2+2NaOH═Na2CO3+H2O
,打开K1的目的是防止B中气压过大,将瓶塞顶起
防止B中气压过大,将瓶塞顶起
.②然后关闭K1和 K3,打开K2,将胶头滴管中的浓氢氧化钠溶液挤入锥形瓶中.稍后打开K3,此时装置C和D中的现象分别是
C中的液体流入D中,B中的液体流入C中,C中澄清的石灰水变浑浊
C中的液体流入D中,B中的液体流入C中,C中澄清的石灰水变浑浊
、C中的液体流入D中形成喷泉,D中溶液变浑浊
C中的液体流入D中形成喷泉,D中溶液变浑浊
,装置C中发生反应的化学方程式为Na2CO3+Ca(OH)2═CaCO3↓+2NaOH
Na2CO3+Ca(OH)2═CaCO3↓+2NaOH
.分析:(1)熟悉常见仪器,了解名称.
(2)根据实验室中制取二氧化碳的反应原理写出方程式;根据反应物的状态和反应条件来选择反应的发生装置,根据二氧化碳的密度及水溶性来选择发生装置.
(3)根据反应及气体的性质,确定发生和收集装置;干燥气体时注意干燥剂的选用--既能吸收水分又不与气体发生反应;
(4)①根据A中的反应生成了二氧化碳,生成的二氧化碳进入B与氢氧化钠反应,写出反应方程式;
②根据压强原理进行推理.
(2)根据实验室中制取二氧化碳的反应原理写出方程式;根据反应物的状态和反应条件来选择反应的发生装置,根据二氧化碳的密度及水溶性来选择发生装置.
(3)根据反应及气体的性质,确定发生和收集装置;干燥气体时注意干燥剂的选用--既能吸收水分又不与气体发生反应;
(4)①根据A中的反应生成了二氧化碳,生成的二氧化碳进入B与氢氧化钠反应,写出反应方程式;
②根据压强原理进行推理.
解答:解:(1)图中b是长颈漏斗.
故答案为:长颈漏斗.
(2)在实验室中制取二氧化碳常用大理石和稀盐酸反应来制取,化学方程式为:CaCO3+2HCl═CaCl2+CO2↑+H2O;药品的状态为:固体+液体,反应条件为:不需要加热,所以应该选择A装置来制取二氧化碳气体,二氧化碳密度比空气大,能够溶于水,所以应该选择F装置来收集二氧化碳;
故答案为:CaCO3+2HCl═CaCl2+CO2↑+H2O;AF.
(3)加热固体氯化铵和熟石灰制取氨气,发生装置应选B;氨气“极易溶于水”,不能用排水法收集,其密度可通过计算相对分子质量来判断:14+1×4=18(18<29),密度比空气小,应用向下排空气法收集;氨水呈碱性,干燥时不能选用浓硫酸作干燥剂,可用碱石灰干燥;
故答案为:B、D、G.
(4)①先打开K1,关闭K2和K3,从长颈漏斗向A 中加入足量的稀盐酸.稀盐酸与A中碳酸钠反应生成二氧化碳,沿导管进入B装置,此时装置B中发生反应的化学方程式为CO2+2NaOH═Na2CO3+H2O,打开K1的目的是防止B中气压过大,将瓶塞顶.
②关闭K1和 K3,打开K2,将胶头滴管中的浓氢氧化钠溶液挤入锥形瓶中.锥形瓶中的二氧化碳与氢氧化钠反应,压强变小,当打开K3时,左侧装置中的压强大,就会将B中液体压入C中,C中液体压入D中;在D中形成喷泉.装置C中反应的化学方程式为Na2CO3+Ca(OH)2═CaCO3↓+2NaOH.
故答案为:①CO2+2NaOH═Na2CO3+H2O;防止B中气压过大,将瓶塞顶起.
②C中的液体流入D中,B中的液体流入C中,C中澄清的石灰水变浑浊;C中的液体流入D中形成喷泉,D中溶液变浑浊;Na2CO3+Ca(OH)2═CaCO3↓+2NaOH.
故答案为:长颈漏斗.
(2)在实验室中制取二氧化碳常用大理石和稀盐酸反应来制取,化学方程式为:CaCO3+2HCl═CaCl2+CO2↑+H2O;药品的状态为:固体+液体,反应条件为:不需要加热,所以应该选择A装置来制取二氧化碳气体,二氧化碳密度比空气大,能够溶于水,所以应该选择F装置来收集二氧化碳;
故答案为:CaCO3+2HCl═CaCl2+CO2↑+H2O;AF.
(3)加热固体氯化铵和熟石灰制取氨气,发生装置应选B;氨气“极易溶于水”,不能用排水法收集,其密度可通过计算相对分子质量来判断:14+1×4=18(18<29),密度比空气小,应用向下排空气法收集;氨水呈碱性,干燥时不能选用浓硫酸作干燥剂,可用碱石灰干燥;
故答案为:B、D、G.
(4)①先打开K1,关闭K2和K3,从长颈漏斗向A 中加入足量的稀盐酸.稀盐酸与A中碳酸钠反应生成二氧化碳,沿导管进入B装置,此时装置B中发生反应的化学方程式为CO2+2NaOH═Na2CO3+H2O,打开K1的目的是防止B中气压过大,将瓶塞顶.
②关闭K1和 K3,打开K2,将胶头滴管中的浓氢氧化钠溶液挤入锥形瓶中.锥形瓶中的二氧化碳与氢氧化钠反应,压强变小,当打开K3时,左侧装置中的压强大,就会将B中液体压入C中,C中液体压入D中;在D中形成喷泉.装置C中反应的化学方程式为Na2CO3+Ca(OH)2═CaCO3↓+2NaOH.
故答案为:①CO2+2NaOH═Na2CO3+H2O;防止B中气压过大,将瓶塞顶起.
②C中的液体流入D中,B中的液体流入C中,C中澄清的石灰水变浑浊;C中的液体流入D中形成喷泉,D中溶液变浑浊;Na2CO3+Ca(OH)2═CaCO3↓+2NaOH.
点评:熟练掌握实验室中制取气体的发生装置和收集装置的选择依据,并能作出正确的选择,记住常见气体制取的反应原理,并能够正确书写化学方程式

练习册系列答案
 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案
相关题目