题目内容
金属在生产生活中应用广泛.(1)每年因金属锈蚀造成很大浪费,铁生锈的条件是
(2)兴趣小组的同学从实验室中收集一桶含有FeSO4、CuSO4的废液.他们想从中回收金属铜和硫酸亚铁晶体,设计了如下方案:
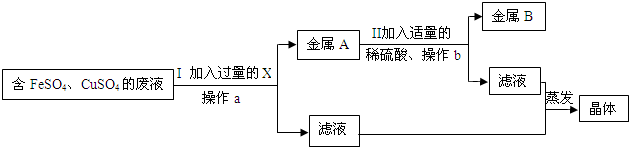
①写出Ⅰ中有关反应的化学方程式
②小红、小强同学在步骤Ⅰ中X能否改用锌的问题上产生了分歧.请你也参与他们的讨论,表明观点,并说明理由
(3)某工厂为防止环境污染和回收金属,向含有AgNO3和Cu(NO3)2的废液中加入一定量的铁粉,充分反应后过滤,向滤渣中加入稀盐酸,无气泡产生.根据上述现象,能得出的结论是
A.滤渣中一定没有Fe B.滤渣中一定有Ag,可能有Cu
C.滤液中一定有Fe(NO3)2,一定没有AgNO3 D.滤液中一定有Fe(NO3)2和Cu(NO3)2.
分析:(1)铁制品容易与水和氧气接触而生锈;用一氧化碳还原氧化铁的化学方程式为3CO+Fe2O3
2Fe+3CO2;
(2)由于目的是获得铜单质和硫酸亚铁,所以需要将铜离子转化为铜单质,而溶液中需要的是硫酸亚铁而不能引入新的杂质,所以加入的能够将铜离子转化为铜单质的只能是单质铁.
(3)根据金属银、铜、铁的活动性由强到弱的顺序铁>铜>银,当把铁粉加入到AgNO3和Cu(NO3)2的混合溶液中,首先置换出银,银被置换完才继续置换铜;
过滤后向滤渣中滴加稀盐酸,无气泡,说明加入的铁已全部发生了反应.
| ||
(2)由于目的是获得铜单质和硫酸亚铁,所以需要将铜离子转化为铜单质,而溶液中需要的是硫酸亚铁而不能引入新的杂质,所以加入的能够将铜离子转化为铜单质的只能是单质铁.
(3)根据金属银、铜、铁的活动性由强到弱的顺序铁>铜>银,当把铁粉加入到AgNO3和Cu(NO3)2的混合溶液中,首先置换出银,银被置换完才继续置换铜;
过滤后向滤渣中滴加稀盐酸,无气泡,说明加入的铁已全部发生了反应.
解答:解:(1)铁制品容易锈蚀,铁生锈的条件是与水和氧气接触;生锈的废钢铁可回收重新冶炼,用一氧化碳还原氧化铁的化学方程式为3CO+Fe2O3
2Fe+3CO2;故答案为:潮湿的空气(或与氧气、水同时接触)、3CO+Fe2O3
2Fe+3CO2
(2)①由于需要将铜离子转化为铜单质,而溶液还必须为硫酸亚铁,即不能引入新的杂质,所以可以加入铁将铜离子转化为铜单质.故答案为:Fe+CuSO4 ═FeSO4 +Cu
②不能用锌,因为锌能够将硫酸亚铁、硫酸铜转化为铁、铜生成了ZnSO4杂质.得到的滤渣是铁、铜混合物;故答案为:不能用锌;锌能够将硫酸亚铁、硫酸铜转化为铁、铜生成了ZnSO4杂质.得到的滤渣是铁、铜混合物
(3)加入的铁全部发生了反应,则一定有银被置换出来;由于铁粉为一定量,所以无法判断铁粉是否与AgNO3完全反应,也就无法进一步判断是否和混合溶液中的往Cu(NO3)2发生了反应;因此,只能得到滤液中一定含有Fe(NO3)2、滤渣中一定含有Ag的结论.
故选A、B
| ||
| ||
(2)①由于需要将铜离子转化为铜单质,而溶液还必须为硫酸亚铁,即不能引入新的杂质,所以可以加入铁将铜离子转化为铜单质.故答案为:Fe+CuSO4 ═FeSO4 +Cu
②不能用锌,因为锌能够将硫酸亚铁、硫酸铜转化为铁、铜生成了ZnSO4杂质.得到的滤渣是铁、铜混合物;故答案为:不能用锌;锌能够将硫酸亚铁、硫酸铜转化为铁、铜生成了ZnSO4杂质.得到的滤渣是铁、铜混合物
(3)加入的铁全部发生了反应,则一定有银被置换出来;由于铁粉为一定量,所以无法判断铁粉是否与AgNO3完全反应,也就无法进一步判断是否和混合溶液中的往Cu(NO3)2发生了反应;因此,只能得到滤液中一定含有Fe(NO3)2、滤渣中一定含有Ag的结论.
故选A、B
点评:在做题过程中,有时前后之间有牵连,有时是没有关系的,所以在解题时就要分析清楚,避免干扰.金属放入盐的混合溶液中,首先把活动性最弱的金属置换出来,置换的先后顺序为由弱到强,最强的最后置换出来.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目


 (2013?西城区一模)金属在生产生活中应用广泛.
(2013?西城区一模)金属在生产生活中应用广泛.