题目内容
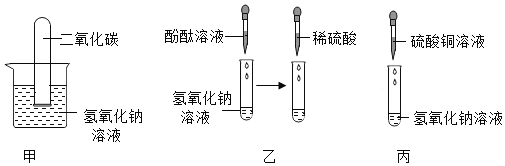
【题目】某化学兴趣小组的同学为了探究氢氧化钠的化学性质,做了如图所示实验。
[查阅资料]①硫酸钠溶液呈中性;②氫氧化镁是难溶于水的白色固体。
(1)甲实验试管中观察到的现象是_____________,此实验不足以证明氢氧化钠和二氧化碳发生了化学反应,因此需补充一个对比实验,请简要写出补充的实验:______________。
(2)乙实验试管中酚酞溶液的作用是______________。
(3)丙实验观察到试管中有蓝色沉淀生成,上层溶液为无色,证明氢氧化钠和硫酸铜发生了化学反应,反应的化学方程式为______________。
(4)实验结束后,小组同学对丙实验试管内无色溶液中溶质的成分展开了探究。
[提出问题]试管中无色溶液溶质的成分是什么?
[猜想假设]猜想一:硫酸钠和氢氧化钠;
猜想二:______________。
[设计实验]要证明猜想一成立,下列试剂中能达到实验 目的的是_____________(填字母序号)。
A 石蕊溶液
B 氯化钡溶液
C 氯化镁溶液
[拓展延伸]小组同学总结了氢氧化钠的化学性质,又联想到学过的氢氧化钙,发现二者化学性质相似,原因是在它们的溶液中都含有相同的_____________(填微粒符号)。
【答案】试管内液面上升 将氢氧化钠溶液换成等体积的水,重复上述实验 通过溶液颜色的变化证明反应的发生 ![]() 硫酸钠 AC OH-
硫酸钠 AC OH-
【解析】
(1)二氧化碳和氢氧化钠反应生成碳酸钠和水,导致试管内的压强小于外界大气压,所以甲实验试管中观察到的现象是:试管内液面上升;此实验不足以证明氢氧化钠和二氧化碳发生了化学反应,因为二氧化碳能溶于水,也会产生试管内液面上升的现象,因此需补充一个对比实验:将氢氧化钠溶液换成等体积的水,重复上述实验;若上升的体积氢氧化钠的大于水的,则说足以证明氢氧化钠和二氧化碳发生了化学反应。
(2)氢氧化钠和硫酸反应生成硫酸钠和水,化学方程式为2NaOH+H2SO4=Na2SO4+2H2O,酚酞遇碱性溶液变红色,遇酸性、中性溶液不变色,所以反应前后溶液现象为由红色变为无色,所以酚酞溶液的作用是:通过溶液颜色的变化证明反应的发生;
(4)猜想假设:
丙实验试管中发生的反应是氢氧化钠和硫酸铜反应生成氢氧化铜沉淀和硫酸钠,2NaOH+CuSO4=Na2SO4+Cu(OH)2↓反应后上层溶液为无色,说明溶液中一定没有硫酸铜,一定含有硫酸钠,可能含有氢氧化钠,所以猜想二是:硫酸钠;
设计实验:要证明猜想一成立,本质上是证明存在氢氧根。
A、紫色石蕊试液遇碱变蓝色,若溶液变蓝色说明存在氢氧化钠,猜想一正确,符合题意;
B、硫酸根离子和钡离子反应会生成硫酸钡沉淀,不能证明猜想一、二哪个成立,不符合题意;
C、氢氧根离子和镁离子会生成氢氧化镁沉淀,说明存在氢氧化钠,猜想一正确,符合题意。故选AC。
拓展延伸:
碱在水溶液中电离出的阴离子全部是氢氧根离子,所以原因是在它们的溶液中都含有相同的OH-。

 名校课堂系列答案
名校课堂系列答案