题目内容
(3分)将6.8 g含杂质的锌粒加入到80 g过量的稀硫酸中(杂质不溶于水,也不与稀硫酸反应),充分反应后过滤,称得滤液质量为86.3g。试计算:
(1)反应生成氢气的质量;
(2)锌粒中所含锌的质量分数(精确到0.1%)。
(1)0.2g;(2)95.6%
解析试题分析:由于参加反应的两反应物,以及反应后的滤液都是混合物,故它们的质量都不能代入方程式进行计算;可设生成的氢气的质量为x,再利用Zn和H2的质量比,换算出Zn的质量,最后根据质量守恒定律可列出方程式进行计算。
解:设生成氢气的质量为x。
Zn + H2SO4 = ZnSO4 + H2↑
65 2
32.5x x
则根据质量守恒定律可得:
参加反应的Zn的质量+稀硫酸的质量=反应后溶液的质量+氢气的质量
即32.5x+80g=86.3g+x
解得,x=0.2g
则锌的质量是32.5x=32.5×0.2g=6.5g
所以锌粒中所含锌的质量分数= 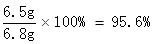
答:反应生成氢气的质量0.2g;锌粒中所含锌的质量分数为95.6%。
点评:此题是关于化学方程式的计算题,主要是利用反应方程式来分析和解决化学计算中的有关问题,要求学生要有较强的分析能力,解题的关键是要会利用锌与氢气的质量比表示出各物质的质量,再结合质量守恒定律列方程进行计算即可。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目