题目内容
【题目】海洋是巨大的资源宝库,从海洋中可以获得很多物质,连云港海水资源丰富。
(1)通过晾晒海水得到的粗盐中含有多种可溶性杂质和不溶性杂质(泥沙等)。实验室中除去粗盐中不溶性杂质获得精盐的步骤是溶解→过滤→蒸发→计算产率等。
①过滤操作中玻璃棒的末端要轻轻的斜靠在______一边。蒸发时为防止液滴飞溅,除用玻璃棒搅拌外,还可以采取的操作______;
②下列操作可能导致精盐产率偏高的是______(填字母)。
a 食盐没有完全溶解即过滤
b 过滤时液面高于滤纸边缘
c 器皿上粘有的精盐没有全部转移到称量纸上
(2)海水中含量最多的氯化物是氯化钠,其次是氯化镁。下图是从海水中获得氯化镁溶液的流程。
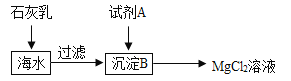
①在海水中加入石灰乳后,发生反应的化学方程式是______;
②上述过程中试剂A与沉淀B发生的是中和反应,则试剂A是(填名称)______。
【答案】三层滤纸 左右移动酒精灯或间歇加热 b MgCl2+Ca(OH)2=Mg(OH)2↓+CaCl2 稀盐酸
【解析】
(1)①过滤操作中,为防止弄破滤纸,玻璃棒的末端要轻轻的斜靠在三层滤纸一边;蒸发时为防止液滴飞溅,除用玻璃棒搅拌外,还可以采取的操作是左右移动酒精灯或间歇加热;
②a、食盐没有完全溶解即过滤,会导致部分精盐损失,从而导致制得的精盐的产率偏低;
b、过滤时液面高于滤纸边缘,会导致部分不溶于水的物质留在精盐中,从而导致制得的精盐的产率偏高;
c、器皿上粘有的精盐没有全部转移到称量纸上,会导致精盐质量偏小,从而导致制得的精盐的产率偏低;
故答案为:(1)①三层滤纸;左右移动酒精灯或间歇加热;②b;
(2)①石灰乳与海水混合,氢氧化钙与氯化镁反应生成氢氧化镁沉淀和氯化钙,反应的化学方程式为:MgCl2+Ca(OH)2=Mg(OH)2↓+CaCl2。
②氢氧化镁难溶于水,与稀盐酸反应能生成氯化镁和水,故试剂X为稀盐酸。
故答案为:①MgCl2+Ca(OH)2═Mg(OH)2↓+CaCl2;②稀盐酸。

【题目】下列化学用语表达正确,且既有宏观意义,又有微观意义的是
选项 | 内 容 | 化学用语 |
A | 地壳中含量最多的金属元素 | AL |
B | 葡萄糖的化学式 | C6H12O6 |
C | 过氧化氢溶液和二氧化锰混合制氧气 | H2O2 |
D | 氯离子的符号 | Cl1- |
A. A B. B C. C D. D