题目内容
(13分)某化学小组同学用下图装置制取一定量的氧气。请你参与探究: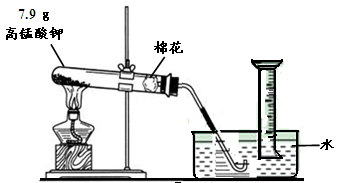
(1) 图14中反应原理为 (用化学方程式表示)。气体发生装置中试管口略向下倾斜的目的是 。为防止水槽中冷水倒吸,实验结束后应先 。
(2)计算7.9 g 高锰酸钾(KMnO4)完全分解,生成氧气的质量是多少?(根据化学方程式计算,写出计算过程)
解:
(3)根据上述计算结果,若常温常压下,氧气的密度约为1.4×10-3 g/mL,则理论上产生氧气体积是 mL (结果保留一位小数)。实际操作过程中,收集到气体的体积大于理论值。请分析:实际收集的气体体积偏大的原因是 (填标号)。
A.装置的气密性不良
B.加热时收集到的气体体积较大
C.部分氧气溶于水
(4)小庆同学认为:根据质量守恒定律,利用高锰酸钾中氧元素的质量分数,计算出7.9 g高锰酸钾中氧元素的质量,即为反应生成的氧气的质量。请分析:小庆的方法是 (填“正确”或“错误”)的,原因是 。
(1)2KMnO4△ K2MnO4+MnO2+O2↑
防止冷凝水倒流,使试管破裂。 (1分) 将导管移出水槽
解:设生成氧气的质量为X
2KMnO4△ K2MnO4+MnO2+O2↑
316 32
7.9 g X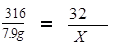
x = 0.8 g
答:生成氧气0.8g。
(3)571.4 ml(1分) B(1分)
(4)错误(1分) 高锰酸钾中的氧元素仅部分转化为氧气(合理即可)
解析试题分析:(1)实验室常用含氧物质的分解来制取氧气,高锰酸钾分解制氧气的反应方程式为:2KMnO4△ K2MnO4+MnO2+O2↑,给固体加热,为了防止冷凝水回流使试管炸裂,所以试管口必须略向下倾斜,实验完毕后,应先撤离导管,后熄灭酒精灯,防止水槽中的水倒吸,使试管急剧冷却引起炸裂。
(2)根据在化学反应中各物质质量成比例,可以根据高锰酸钾的质量计算生成氧气的质量,注意规范解题的过程(设、写、标、列、解、答)。
解:设生成氧气的质量为X
2KMnO4△ K2MnO4+MnO2+O2↑
316 32
7.9 g X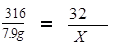
x = 0.8 g
答:生成氧气0.8g。
(3)用排水法收集氧气,实际收集到的氧气比理论值偏大,是因为氧气受热体积膨胀引起的。
(4)根据元素守恒来计算高锰酸钾产生氧气的质量是错误的,应为高锰酸钾完全分解后,氧元素未转化为氧气,剩余的固体锰酸钾和二氧化锰中还有氧元素。
考点:气体的制取和收集、根据化学方程式计算

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案收集气体的常用方法有:①向上排空气法 ②向下排空气法③排水法。已知在标准状况下,氢气的密度比空气小,难溶于水,那么收集氢气的方法是
| A.①② | B.①③ | C.②③ | D.① |