题目内容
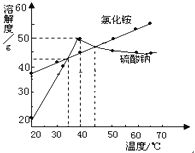
【题目】如图是甲、乙、丙三种固体物质的溶解度曲线,请回答:

(1)t2℃时,甲、乙、丙三种物质的溶解度由小到大的顺序是 .
(2)若将甲物质的不饱和溶液变为饱和溶液,下列说法不正确的是 (填写字母)。
A.溶剂的质量一定变小
B.溶质的质量可能不变
C.溶质的质量分数一定变大
D.溶液的质量一定变大
E.该饱和溶液还可以溶解其他物质
(3)将t2℃时,甲、乙、丙三种物质的饱和溶液,都降温至tl℃时,所得溶液的溶质质量分数由大到小的顺序是 ;
(4)若甲物质溶液中混有少量的乙物质,提纯甲物质可采取的方法是 ;
(5)对(4)析出的晶体和剩余溶液描述不正确的是 (填写字母)
A.剩余溶液一定是甲饱和溶液 B.剩余溶液一定不含有乙
C.剩余的溶液一定是纯净物 D.析出的晶体中只含有甲
【答案】(1)丙<乙<甲;(2)ACD;(3)乙>甲>丙;(4)降温结晶;(5)BCD
【解析】
试题分析:(1)t2℃时,甲、乙、丙三种物质的溶解度由小到大的顺序是丙<乙<甲;
(2)甲的溶解度随温度升高而增大,若将甲物质的不饱和溶液变为饱和溶液,可采取加入溶质、蒸发溶剂、降温的方法;
A、若采取降温和加入溶质的方法,则溶剂的质量不变,故错误;
B、若采取蒸发溶剂、降温的方法,溶质的质量不变,若采取加入溶质的方法,溶质的质量增加,所以溶质的质量可能不变,正确;
C、若采取降温至恰好饱和的方法,溶质的质量分数不变,故错误;
D、若采取降温至恰好饱和的方法,溶液的质量不变,故错误;
(3)甲、乙的溶解度随温度升高而增大,丙的溶解度随温度升高而减小,所以将t2℃时,甲、乙、丙三种
物质的饱和溶液,都降温至t1℃时,甲、乙析出晶体,溶质的质量分数减小,丙溶解度增大,溶质的质量分数与降温前相等,饱和溶液中溶质的质量分数=溶解度÷(溶解度+100g)×100%,即溶解度越大质量分数也就越大,而t1℃时乙的溶解度大于甲的溶解度大于t2℃时丙的溶解度,故所得溶液的溶质质量分数由大到小的顺序是乙>甲>丙.
(4)若甲物质的溶解度受温度的影响较大,且随温度的降低而减小, 乙物质的溶解度受温度的影响较小,提纯甲物质可采取的方法是降温结晶(又叫冷却热饱和溶液)。
(5)A.析出的晶体甲后的溶液一定是甲的饱和溶液
B.降温时乙析出的很少,剩余溶液一定含有乙
C.剩余的溶液中含有少量的甲和一定量的乙,是混合物
D.甲、乙的溶解度都随温度的降低而减小,析出的晶体中只既有甲,也有乙,只是甲较多,乙较少。

【题目】KCl在不同温度下溶解度的数据如下表:
温度℃ | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 | 100 |
溶解度/g | 27.6 | 31.0 | 34.0 | 37.0 | 40.0 | 42.6 | 45.5 | 48.3 | 51.1 | 54.0 | 56.7 |
(1)60℃时,100g水中最多可溶解KCl g.
(2)90℃时,100g饱和KCl溶液冷却到30℃时,溶液的质量(选填“>”或“<”或“=”) 100g.
(3)40℃时,KCl饱和溶液中溶质质量分数为 ;该溶液升温到60℃时,溶液属于 溶液(选填“饱和”或“不饱和”).