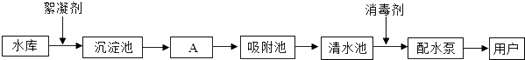
题目内容
【题目】科学家设想利用太阳能加热器“捕捉CO2”、“释放CO2”,实现碳循环. 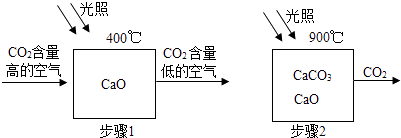
(1)步骤1的化学方程式为 .
(2)为确定步骤2中的碳酸钙是否完全分解,设计的实验步骤为:取少量固体于试管中,滴加过量溶液,若观察到试管内 . 则分解不完全.
(3)上述设想的优点有(填字母序号). a.原料易得且可循环利用 b.充分利用太阳能 c.可全地域全天候使用
(4)CO2是宝贵的碳氧资源.CO2和H2在一定条件下可合成甲酸(HCOOH),此反应中CO2与H2的分子个数比为 , 若要检验1%甲酸水溶液是否显酸性,能选用的有(填字母序号). a.无色酚酞溶液 b.紫色石蕊溶液 c.PH试纸
(5)请列举CO2的另两种用途 , .
【答案】
(1)CaO+CO2 ![]() CaCO3
CaCO3
(2)盐酸;有气泡产生
(3)ab
(4)1:1;bc
(5)灭火;制碳酸饮料
【解析】解:(1)根据图示信息可知二氧化碳和氧化钙在400℃生成碳酸钙,方程式是:CaO+CO2 ![]() CaCO3;(2)因为碳酸钙遇酸产生二氧化碳,所以取少量固体于试管中,滴加过量盐酸,若观察到试管内有气泡产生,则含有未分解的碳酸钙;(3)观察流程图可以看出反应原料是氧化钙和二氧化碳,反应条件是利用太阳能,因此有原料易得且可循环利用,充分利用太阳能的优点,但会受到地域、天气的限制的缺点,故可全地域全天候使用是错误的;(4)一分子的CO2和一分子的H2在一定条件下可合成一分子的甲酸(HCOOH),因此此反应中CO2与H2的分子个数比为1:1;酸性物质能够使紫色的石蕊试液变成红色,不能使酚酞试液变色,用pH试纸测定的pH会<7,因此选择bc;(5)因为二氧化碳不能燃烧,也不能支持燃烧,密度比空气大,故可以用来灭火; 二氧化碳溶于水产生碳酸,可以制碳酸饮料等,另外还可以做制冷剂、人工降雨等.
CaCO3;(2)因为碳酸钙遇酸产生二氧化碳,所以取少量固体于试管中,滴加过量盐酸,若观察到试管内有气泡产生,则含有未分解的碳酸钙;(3)观察流程图可以看出反应原料是氧化钙和二氧化碳,反应条件是利用太阳能,因此有原料易得且可循环利用,充分利用太阳能的优点,但会受到地域、天气的限制的缺点,故可全地域全天候使用是错误的;(4)一分子的CO2和一分子的H2在一定条件下可合成一分子的甲酸(HCOOH),因此此反应中CO2与H2的分子个数比为1:1;酸性物质能够使紫色的石蕊试液变成红色,不能使酚酞试液变色,用pH试纸测定的pH会<7,因此选择bc;(5)因为二氧化碳不能燃烧,也不能支持燃烧,密度比空气大,故可以用来灭火; 二氧化碳溶于水产生碳酸,可以制碳酸饮料等,另外还可以做制冷剂、人工降雨等.
所以答案是:(1)CaO+CO2 ![]() CaCO3;(2)盐酸;有气泡产生;(3)ab;(4)1:1;bc;(5)灭火;制碳酸饮料.
CaCO3;(2)盐酸;有气泡产生;(3)ab;(4)1:1;bc;(5)灭火;制碳酸饮料.
【考点精析】本题主要考查了混合物的分离方法的相关知识点,需要掌握混合物的分离:1、过滤法:分离可溶物 + 难溶物2、结晶法:分离几种可溶性物质才能正确解答此题.

 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案 一线名师权威作业本系列答案
一线名师权威作业本系列答案