题目内容
【题目】某厂排放的废水中含有碳酸钠,易造成环境污染。化学兴趣小组为该厂设计废水处理和利用的方案.讲行了如下实验:取过滤后的水样200 g,逐滴加入稀盐酸至恰好不再产生气体为止,反应过程中生成气体与所加稀盐酸的质量关系如图所示。请回答下列问题(不考虑水样中杂质的影响):
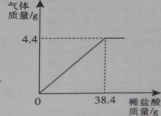
(I)反应生成C02气体的质量是 g;
(2)反应后生成氯化钠的质量是多少?(写出计算过程)
(3)农业上常用10%一20%的氯化钠溶液来选种。请通过列式计算判断:上述实验反应后所得溶液能否直接用于农业上选种?
【答案】(1)4.4 (2)11.7g (3)不能
【解析】由图可知38.4g稀盐酸恰好与水样中的碳酸钠完全反应,水样中碳酸钠完全反应生成气体的质量为4.4g,根据二氧化碳的质量可计算出生成氯化钠的质量,反应后溶液的质量应该减去反应生成的二氧化碳的质量。
解:设反应后生成氯化钠的质量为x。
Na2CO3+2HCl=2NaCl+H2O+CO2↑(2分)
117 44 (1分)
x 4.4g
![]() (1分)
(1分)
解得:x=11.7g(1分)
答:反应生成氯化钠的质量为11.7g。(设、答全对给1分)
(3)反应后溶液中溶质的质量分数=![]() ×100%=5%<10%,故不能直接用于农业上选种。(2分)
×100%=5%<10%,故不能直接用于农业上选种。(2分)

 名校课堂系列答案
名校课堂系列答案【题目】在化学课上,甲同学将燃烧的钠迅速伸入到盛有CO2的集气瓶中,钠在其中继续燃烧,反应后冷却,瓶底附着黑色颗粒,瓶壁上粘附着白色物质.
(提出问题)黑色颗粒和白色物质是什么?
(进行猜想)甲认为黑色颗粒是___,白色物质可能是Na2O或___,乙同学还认为白色物质是氢氧化钠.
甲同学立刻认为乙同学的猜想是错误的,其理由是___.
(查阅资料)氧化钠为白色粉末,溶于水生成氢氧化钠:Na2O+H2O═2NaOH
(实验探究)甲同学对白色物质进行实验探究.
实验方案 | 实验操作 | 实验现象 | 结论 |
方案1 | 取样品少量于试管中,加入适量水,振荡,样品全部溶于水,向其中加入无色酚酞试液 | 溶液变成红色 | 白色物质为 Na2O |
方案2 | ①取样品少量于试管中,加入适量水,振荡,样品全部溶于水,向其中加入过量的CaCl2溶液 | 出现白色沉淀 | 白色物质为 ___ |
②静置片刻,取上层清液于试管中,滴加无色酚酞试液 | 无明显现象 |
(反思评价)丙同学认为方案1得到的结论不正确,其理由是___.
(得出结论)钠在二氧化碳中燃烧的化学方程式为___.
通过以上探究,你还能获得哪些结论,请写出一条:___.
【题目】图表法是一种常用的数据处理方法。下表记录了氢氧化钠、碳酸钠在水和酒精中的溶解度,下列说法正确的是( )
氢氧化钠 | 碳酸钠 | |||
20℃ | 40℃ | 20℃ | 40℃ | |
水 | 109g | 129g | 21.8g | 49g |
酒精 | 17.3g | 40g | 不溶 | 不溶 |

A. 如图表示碳酸钠的溶解度曲线
B. 氢氧化钠和碳酸钠在水中都是易溶物质
C. 40℃时若将50g氢氧化钠分别投入到100g水和100g酒精中,均能形成饱和溶液
D. 20℃时将二氧化碳分别通入氢氧化钠的水溶液和酒精溶液中,均无明显现象