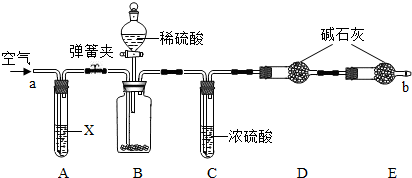
题目内容
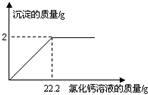 用“侯氏制碱法”制得的纯碱常含有少量的氯化钠.为测定某纯碱样品中碳酸钠的含量,小明称取该纯碱样品5g,充分溶解于水中,再滴加氯化钙溶液,产生沉淀的质量与加入氯化钙溶液的质量关系如右图所示.求:
用“侯氏制碱法”制得的纯碱常含有少量的氯化钠.为测定某纯碱样品中碳酸钠的含量,小明称取该纯碱样品5g,充分溶解于水中,再滴加氯化钙溶液,产生沉淀的质量与加入氯化钙溶液的质量关系如右图所示.求:(1)该纯碱样品中碳酸钠的质量.(精确到0.1%)
(2)所加入氯化钙溶液的溶质质量分数.
分析:(1)欲求该纯碱样品中碳酸钠的质量分数,须先根据化学方程式求出样品中碳酸钠的质量,再利用质量分数公式计算即可.
(2)欲求所加入氯化钙溶液的溶质质量分数,须先根据化学方程式求出溶质的质量,再根据溶质质量分数的计算公式进行计算即可.
(2)欲求所加入氯化钙溶液的溶质质量分数,须先根据化学方程式求出溶质的质量,再根据溶质质量分数的计算公式进行计算即可.
解答:解:依据图象可知该反应生成的最大沉淀量是2g,此时加入的氯化钙溶液的质量是22.2g;
设该纯碱样品中碳酸钠的质量为x,22.2g氯化钙溶液中溶质的质量为y,则
Na2CO3+CaCl2═CaCO3↓+2NaCl
106 111 100
x y 2g
=
=
解之得:x=2.12g,y=2.22g;
所以,该纯碱样品中碳酸钠的质量分数为:
×100%=42.4%;
所加入氯化钙溶液的溶质质量分数为:
×100%=10%;
答:(1)该纯碱样品中碳酸钠的质量分数为42.4%;
(2)所加入氯化钙溶液的溶质质量分数为10%.
设该纯碱样品中碳酸钠的质量为x,22.2g氯化钙溶液中溶质的质量为y,则
Na2CO3+CaCl2═CaCO3↓+2NaCl
106 111 100
x y 2g
| 106 |
| x |
| 111 |
| y |
| 100 |
| 2g |
解之得:x=2.12g,y=2.22g;
所以,该纯碱样品中碳酸钠的质量分数为:
| 2.12g |
| 5g |
所加入氯化钙溶液的溶质质量分数为:
| 2.22g |
| 22.2g |
答:(1)该纯碱样品中碳酸钠的质量分数为42.4%;
(2)所加入氯化钙溶液的溶质质量分数为10%.
点评:题是借助于数学模型,利用图表的方式来分析和解决化学计算中的有关问题,要求学生有较强的识图能力和数据分析能力.

练习册系列答案
 步步高达标卷系列答案
步步高达标卷系列答案
相关题目