题目内容
侯氏制碱法为纯碱工业的发展做出了杰出的贡献.用此方法制得的工业纯碱产品中会含有一定量的氯化钠.为测定一种用侯氏制碱法生产的工业纯碱产品中碳酸钠的纯度,现取26.5g该工业纯碱样品.加入100g某溶质质量分数的稀盐酸,恰好完全反应,得到117.7g不饱和溶液.请回答下列问题:
(1)加入稀盐酸发生反应的化学方程式为 ;
(2)求解样品中碳酸钠质量(x)的比例式为 ;
(3)样品中碳酸钠的纯度为 ;
(4)若向反应后的溶液中加入54.5g水,则所得溶液中溶质和溶剂的质量最简比为 ;
(5)工业上常用碳酸钠和氢氧化钙反应来制取氢氧化钠.若要用这种方法制得20t含氢氧化钠80%的工业烧碱,需要上述用侯氏制碱法获得的工业纯碱产品的质量是 .
(1)Na2C03+2HCl═2NaCl+H20+C02↑;(2)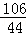 =
=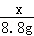 ;(3)80%;(4)1:5;(5)26.5t.
;(3)80%;(4)1:5;(5)26.5t.
【解析】(1)碳酸钠和盐酸反应生成了氯化钠、水和二氧化碳,可以写出反应的化学方程式为:Na2C03+2HCl═2NaCl+H20+C02↑;
(2)根据质量守恒定律可以知道生成二氧化碳的质量为:100g+26.5g﹣117.7g=8.8g;
设样品中碳酸钠质量为x,生成氯化钠的质量为y
Na2C03+2HCl═2NaCl+H20+C02↑;
106 117 44
x y 8.8g
根据化学方程式中碳酸钠和二氧化碳的质量关系可以列出它们的比例关系为:
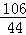 =
=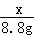 解得:x=21.2g
解得:x=21.2g
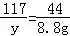 解得:y=23.4g
解得:y=23.4g
(3)根据(2)中比例式可以求出碳酸钠的质量为:21.2g
所以该样品中碳酸钠的质量分数为: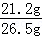 ×100%=80%;
×100%=80%;
(4)反应溶液中氯化钠的质量为:25.6g﹣21.2g+23.4g=28.7g
而加入54.5g水后,溶液在溶剂的质量为:54.5g+117.7g﹣28.7g=143.5g
所以该溶液中溶质和溶剂的质量比为:28.7g:143.5g=1:5;
(5)设需要改纯碱的质量为z,则:
Ca(OH)2+Na2CO3═CaCO3↓+2NaOH
106 80
80%•z 20t×80%=16t
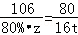
解得:z=26.5t
答:需要上述用侯氏制碱法获得的工业纯碱产品的质量是26.5t.

 阅读快车系列答案
阅读快车系列答案