题目内容
【题目】盐城市2013年中考化学实验考查有:①氧气的制取;②二氧化碳的制取;③配制50g5%的NaCl溶液…等六个考签,由学生抽签确定一个考题进行考查. 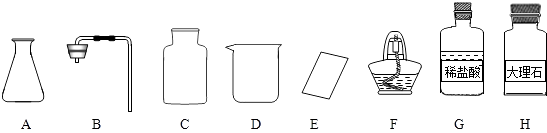
(1)甲同学抽签后来到实验室,发现本组实验桌上主要准备了下列仪器和药品: ①图中仪器D的名称是 , F的名称是 .
②甲同学抽到的考签应该是(填字母代号).
A.氧气的制取 B.二氧化碳的制取
③制取该气体的反应原理为(用化学方程式表示).制取一瓶该气体,应选用的仪器有(填字母代号).
④甲同学实验的主要步骤示意如下,请你帮他补充完整.
组合装置→检验气密性→→收集气体.
⑤利用上述气体发生装置还可以制取其它气体,请写出其中一种反应的化学方程式: .
(2)乙同学在完成“配制50g5%的NaCl溶液”实验过程中,通过计算,需称取g.量取水约mL.溶解NaCl时用到的玻璃棒的作用是
【答案】
(1)烧杯;酒精灯;B;CaCO3+2HCl=CaCl2+H2O+CO2↑;ABCE;添加药品;2H2O2 ![]() 2H2O+O2↑
2H2O+O2↑
(2)2.5;47.5;加速溶解
【解析】解:(1)①仪器D的名称是烧杯;F的名称是酒精灯;②根据给定的药品稀盐酸和大理石及仪器,甲同学抽到的考签应该是:二氧化碳的制取;③制取二氧化碳的药品是石灰石和稀盐酸,反应产生氯化钙、水和二氧化碳,反应的方程式为:CaCO3+2HCl=CaCl2+H2O+CO2↑;发生装置是固体和液体在常温下的反应,需要的仪器有:AB;因为二氧化碳易溶于水,密度比空气大,故采用向上排空气法收集,需要的仪器有:CE;④该法制取二氧化碳的步骤是:组合装置、检查装置的气密性、装药品、收集气体;⑤发生装置属于固液常温型的装置,因此可以是实验室用过氧化氢溶液和二氧化锰制取氧气,其中二氧化锰是催化剂,反应的化学方程式为:2H2O2 ![]() 2H2O+O2↑;(2)配制50g5%的NaCl溶液,需要氯化钠的质量=50g×5%=2.5g;需要水的质量=50g﹣2.5g=47.5g;溶解NaCl时用到的玻璃棒的作用是加速溶解; 所以答案是:(1)①烧杯;酒精灯;②B;③CaCO3+2HCl=CaCl2+H2O+CO2↑;ABCE④添加药品;⑤2H2O2
2H2O+O2↑;(2)配制50g5%的NaCl溶液,需要氯化钠的质量=50g×5%=2.5g;需要水的质量=50g﹣2.5g=47.5g;溶解NaCl时用到的玻璃棒的作用是加速溶解; 所以答案是:(1)①烧杯;酒精灯;②B;③CaCO3+2HCl=CaCl2+H2O+CO2↑;ABCE④添加药品;⑤2H2O2 ![]() 2H2O+O2↑;(2)2.5;47.5;加速溶解.
2H2O+O2↑;(2)2.5;47.5;加速溶解.
【考点精析】认真审题,首先需要了解制取二氧化碳的操作步骤和注意点(1)原理:用石灰石和稀盐酸反应: CaCO3+2HCl==CaCl2+H2O+CO2↑2) 选用和制氢气相同的发生装置3)气体收集方法:向上排空气法4)验证方法:将制得的气体通入澄清的石灰水,如能浑浊,则是二氧化碳.验满方法:用点燃的木条,放在集气瓶口,木条熄灭.证明已集满二氧化碳气体).

【题目】某奶制品的营养成分见表
项目 | 每100mL | NRV% |
能量 | 290kJ | 3% |
蛋白质 | 3.2g | 5% |
脂肪 | 4.0g | 7% |
碳水化合物 | 4.8g | 2% |
钠盐 | 62mg | 3% |
(1)和水也是人体必需的基本营养物质,但在表中未标示.
(2)该奶制品中能够提供能量(任写一种).
(3)奶制品中含有丰富的钙(填“单质”、“原子”或“元素”),儿童每日要摄取足够量的钙,才能避免(填字母序号). a.贫血症 b.佝偻病 c.甲状腺肿大
(4)如图是奶制品的两种包装.其中所使用的主要材料属于有机合成材料的是(填字母序号,下同),属于无机合成材料的是 , 应放入标有  的垃圾箱中的是 .
的垃圾箱中的是 .
(5)下列物质不会使蛋白质失去原有生理活性的是(填字母序号). a.浓硫酸 b.乙酸铅 c.硫酸铵 d.甲醛.
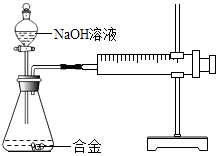
【题目】合金在生活中应用十分广泛.已知某合金粉末除含铝外,还含有铁、铜中的一种或两种.小明利用如图装置对合金粉末中铁、铜的存在进行探究时,误把氢氧化钠溶液当成稀硫酸加入到锥形瓶中,他惊奇的发现有无色气体放出,注射器活塞向右移动. 【提出问题】难道NaOH溶液也能与某些金属发生化学反应吗?
【查阅资料】
①铝能与氢氧化钠溶液反应,铁、铜不能与氢氧化钠溶液反应.
②铝与氢氧化钠溶液反应的化学方程式为:2Al+2NaOH+2H2O═2NaAlO2+3H2↑(NaAlO ![]() 溶于水,溶液现无色)
溶于水,溶液现无色)
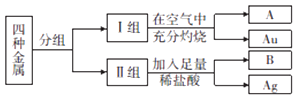
(1)【进行猜想】猜想1:该合金粉末中除铝外,还含有铁. 猜想2:该合金粉末中除铝外,还含有 .
猜想3:该合金粉末中除铝外,还含有铁、铜.
(2)【实验探究】下列实验(见表1)仅供选用的试剂:20%的硫酸溶液、30%的NaOH溶液. 表1实验记录
实验步骤 | 实验现象 | 结论 |
①取一定量的合金粉末,加过量的 , 充分反应后过滤,滤渣备用 | 粉末部分溶解,并有无色气体放出 | 合金中一定含有 |
②取步骤①所得滤渣,加过量 , 充分反应 | 滤渣部分溶解,并有无色气体放出,溶液呈浅绿色 | 合金中一定含有 |
(3)【得出结论】猜想3成立. 【反思】
①一般来说,活泼金属能与稀硫酸等算反应,而铝与酸、碱都能反应,说明铝具有特殊的性质.铝与稀硫酸发生化学反应的基本类型是反应.
②上述实验中用到的稀硫酸由浓硫酸稀释得到,稀释浓硫酸的方法是:把 , 并不断搅拌.
③若小明向合金粉末中加入的是足量的稀硫酸,则最终剩余的固体成分是 .
【拓展与分析】请你设计一个实验方案,比较铝、铁、铜的金属活动性强弱 .