题目内容
某化学兴趣小组对“氢氧化钠与稀盐酸反应中溶液温度升高的现象”进行了实验探究.在一定体积10%的氢氧化钠溶液中滴加10%的盐酸,并对反应中溶液的温度与加入盐酸的体积变化记录如下:
| 加入盐酸体积V(mL) | 0 | 2 | 6 | 10 | 16 | 20 |
| 测得溶液温度t℃ | 14.0 | 15.2 | 22.0 | 28.2 | 24.7 | 22.9 |

请回答下列问题:
(1)写出氢氧化钠与稀盐酸反应的化学方程式________.
(2)在如图中,绘出溶液的温度与加入盐酸的体积之间的变化关系曲线.
(3)根据实验可得出结论是________.
(4)根据曲线讨论溶液温度变化的原因.加入盐酸的量在2-10mL之间时:________;加入盐酸的量在lO-20mL之间时:________.
(2)由实验数据绘出溶液的温度与加入盐酸的体积之间的变化关系曲线:
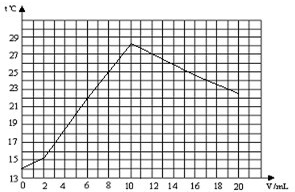 ;
;(3)根据实验可得出结论是:氢氧化钠与稀盐酸反应会放出热量;
(4)曲线讨论溶液温度变化的原因.加入盐酸的量在2-10mL之间时:反应放出热量,使溶液温度升高;加入盐酸的量在lO-20mL之间时:随着盐酸溶液不断加入,氢氧化钠完全反应后,不再放出热量,溶液体积增大,溶液温度下降.
故答案:
(1)NaOH+HCl=NaCl+H2O;
(2)
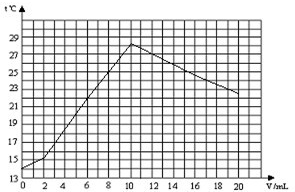
(3)氢氧化钠与稀盐酸反应会放出热量;
(4)反应放出热量,使溶液温度升高; 随着盐酸溶液不断加入,氢氧化钠完全反应后,不再放出热量,溶液体积增大,溶液温度下降.
分析:(1)根据氢氧化钠能与盐酸反应生成氯化钠和水进行解答;
(2)根据实验数据绘出溶液的温度与加入盐酸的体积之间的变化关系曲线;
(3)根据氢氧化钠与稀盐酸反应会放出热量进行解答;
(4)根据实验现象可以判断溶液的酸碱性方面的情况.
点评:本题主要考查了化学方程式的书写及其根据实验现象判断溶液的酸碱性方面的内容,完成此题,可以依据已有的知识进行.

 阅读快车系列答案
阅读快车系列答案碳酸氢钠常用于食品和医药工 业,某化学兴趣小组对碳酸氢钠进行探究。
业,某化学兴趣小组对碳酸氢钠进行探究。
【查阅资料】 Ⅰ.碳酸氢钠受热容易分解,生成水、二氧化碳气体和一种常见的固体物质。
 Ⅱ.碳酸钠溶液呈碱性。
Ⅱ.碳酸钠溶液呈碱性。
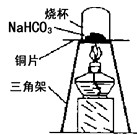
【进行实验】为了验证碳酸氢钠受热时会分解,兴趣小组
的同学取一定质量的碳酸氢钠到铜片上加热,如图所示。
(1)加热一段时间后,观察到烧杯内壁有__________。
(2)充分加热后,将烧杯迅速倒转过来,倒入适量的
澄清石灰水,振荡,观察到石灰水变浑浊。写出
该反应的化学方程式:___________________。
(3)兴趣小组的同学认为:充分加热后的固体产物可能是NaOH或Na2CO3。
①他们的依据是____________________________________。
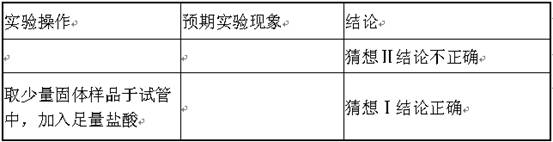
②兴趣小组为了确定反应后的固体产物成分进行以下实验,请填写下表:
| 实验 | 实验现象 | 结论 |
| 实验一:取少量反应后的固体产物溶于水,滴入几滴酚酞试液 | 溶液变成红色 | 固体产物是NaOH,而不是Na2CO3 |
| 实验二:取少量反应后的固体产物溶于水,加入氯化钙溶液 | _____________
| 固体产物是Na2CO3,而不是NaOH |
| 实验三:___________________ ___________________________ | 产生大量气泡 | 固体产物是Na2CO3,而不是NaOH |
【讨论与评价】实验一的结论与实验二、实验三的结论相反,在讨论时兴趣小组的同学认为方案一的结论不正确,他们的理由是_____________________________________________。
【总结】请写出碳酸氢钠受热分解的化学方程式________________________。
(4)某碱厂的主要产品之一是小苏打(碳酸氢钠),为了测定产品中碳酸氢钠的质量分数(假设该样品中只含氯化钠一种杂质),取样品10.0 g逐滴加入稀盐酸,所得气体的质量为4.4 g。求:样品中碳酸氢钠的质量分数。
 (2011?黄石)碳酸氢钠常用于食品和医药工业、某化学兴趣小组对碳酸氢钠的热稳定性进行探究.
(2011?黄石)碳酸氢钠常用于食品和医药工业、某化学兴趣小组对碳酸氢钠的热稳定性进行探究. 碳酸氢钠常用于食品和医药工业,某化学兴趣小组对碳酸氢钠进行探究.
碳酸氢钠常用于食品和医药工业,某化学兴趣小组对碳酸氢钠进行探究.