题目内容
如图所示,实验室有一瓶标签被部分腐蚀的盐溶液,为确定其成分几位同学进行了如下研究.
【提出假设】几位同学对其溶质提出了不同的假设
甲同学认为:可能是NaCl
乙同学认为:可能是NaOH
丙同学认为:可能是Na2CO3
丁同学认为:可能是Na2SO4上述假设中一定错误的是
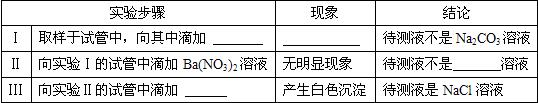
【实验探究】排除了错误的假设后,几位同学设计了如下方案,通过实验,验证他们的假设,请完成实验报

【提出假设】几位同学对其溶质提出了不同的假设
甲同学认为:可能是NaCl
乙同学认为:可能是NaOH
丙同学认为:可能是Na2CO3
丁同学认为:可能是Na2SO4上述假设中一定错误的是
乙
乙
,除上述假设外你认为该溶液还有可能是NaHCO3或NaNO3
NaHCO3或NaNO3
溶液.【实验探究】排除了错误的假设后,几位同学设计了如下方案,通过实验,验证他们的假设,请完成实验报

分析:由题意可知,该溶液是盐溶液,NaOH属于碱,故乙同学的假设一定错误.含Na元素的盐,除去NaCl、Na2CO3、Na2SO4外,初中阶段还接触到了NaHCO3和NaNO3,两者都有可能.
表中1,因Na2CO3溶液呈碱性,可可向溶液中滴加无色酚酞试液,看是否变红;滴加紫色石蕊试液,看是否变蓝;从检验CO32-的角度考虑,也可滴加稀硝酸,看是否有气泡产生,但不能滴加稀硫酸或稀盐酸,因第二步要加Ba(NO3)2溶液检验Na2SO4是否存在,第三部要检验NaCl是否存在,若用硫酸或盐酸都会对后面试液干扰.
表中2,是检验是否是Na2SO4溶液,即检验SO42-,因硫酸盐中只有硫酸钡白色沉淀,故加入Ba(NO3)2溶液来验证,但不能用氯化钡代替,因第三部要检验NaCl是否存在.
表中3,检验NaCl溶液用硝酸银溶液生成不溶于水也不溶于酸的白色沉淀氯化银.
表中1,因Na2CO3溶液呈碱性,可可向溶液中滴加无色酚酞试液,看是否变红;滴加紫色石蕊试液,看是否变蓝;从检验CO32-的角度考虑,也可滴加稀硝酸,看是否有气泡产生,但不能滴加稀硫酸或稀盐酸,因第二步要加Ba(NO3)2溶液检验Na2SO4是否存在,第三部要检验NaCl是否存在,若用硫酸或盐酸都会对后面试液干扰.
表中2,是检验是否是Na2SO4溶液,即检验SO42-,因硫酸盐中只有硫酸钡白色沉淀,故加入Ba(NO3)2溶液来验证,但不能用氯化钡代替,因第三部要检验NaCl是否存在.
表中3,检验NaCl溶液用硝酸银溶液生成不溶于水也不溶于酸的白色沉淀氯化银.
解答:解:因NaOH属于碱,故乙同学的假设一定错误;初中阶段接触到的钠盐还有NaHCO3和NaNO3,故假设还有可能为NaHCO3或NaNO3 .故答案为:乙; NaHCO3和NaNO3;
表中1结论为不是Na2CO3,前面的实验步骤和现象都围绕其性质展开,其溶液呈碱性,遇酸产生能使石灰水变浑浊的气体等.
故答案可为:滴加酚酞试液;不变色. 滴加紫色石蕊试液;不变色. 滴加稀硝酸;无气泡产生.
表中2滴加硝酸钡无现象,我们知道含有NO3-的盐均能溶于水,而含有Ba2+的盐中BaCO3与BaSO4均不溶于水,生成物中有它们时,现象为白色沉淀.实验1中证明没有Na2CO3,本实验中无现象,说明没有Na2SO4,故答案为:Na2SO4
表中3结论为是氯化钠,现象为白色沉淀,遇氯化钠产生白色沉淀的只有硝酸银溶液,故答案为:AgNO3
表中1结论为不是Na2CO3,前面的实验步骤和现象都围绕其性质展开,其溶液呈碱性,遇酸产生能使石灰水变浑浊的气体等.
故答案可为:滴加酚酞试液;不变色. 滴加紫色石蕊试液;不变色. 滴加稀硝酸;无气泡产生.
表中2滴加硝酸钡无现象,我们知道含有NO3-的盐均能溶于水,而含有Ba2+的盐中BaCO3与BaSO4均不溶于水,生成物中有它们时,现象为白色沉淀.实验1中证明没有Na2CO3,本实验中无现象,说明没有Na2SO4,故答案为:Na2SO4
表中3结论为是氯化钠,现象为白色沉淀,遇氯化钠产生白色沉淀的只有硝酸银溶液,故答案为:AgNO3
点评:该题主要考查常见离子的检验,做题时要充分考虑所选试剂不能造成干扰.

练习册系列答案
相关题目