题目内容
 有一瓶放置时间较久的钙片.
有一瓶放置时间较久的钙片.
(1)瓶内有一装有白色颗粒状固体的小纸袋,上面写着“生石灰干燥剂,切勿食用”.
①生石灰可作干燥剂的理由是它能与______作用生成氢氧化钙.“切勿食用”是因为转化过程中会______热(填“吸”或“放”),且生成的氢氧化钙对皮肤有强烈的______ 性.
②小东同学认为,由于放置时间过久,这包生石灰中可能部分转化成了碳酸钙.原因是氢氧化钙会与空气中的______发生反应.证明碳酸钙存在的实验方法为______.
(2)瓶壁上破损的标签如图所示.
小东同学为了测定每片钙片含钙的质量进行了如下研究.
取10片钙片加入到盛有20g盐酸的烧杯中,完全反应后测得烧杯中剩余物总质量为24.7g;反应的化学方程式为CaCO3+2HCl═CaCl2+CO2↑+H20.
计算:
(1)10片钙片的总质量为______g;
(2)10片钙片与盐酸完全反应产生二氧化碳的质量为______g;
(3)10片钙片中含碳酸钙的总质量.
(4)每片钙片中含钙的质量.
解:(1)①生石灰氧化钙能与水反应生成氢氧化钙,反应过程中放出大量的热,所得到的氢氧化钙呈碱性,对皮肤有强烈的腐蚀性;
②氢氧化钙能与二氧化碳发生反应生成碳酸酸钙,向久置的一包生石灰中滴加稀盐酸,若有气体产生则说明已变质生成了碳酸钙,这是利用碳酸钙与盐酸反应放出二氧化碳的变化规律;
(2)①根据标签中所标注:每瓶50片,重40g的信息,可得知10片钙片的总质量= ×40g=8g;
×40g=8g;
②根据质量守恒定律,10片钙片与盐酸完全反应产生二氧化碳的质量=8g+20g-24.7g=3.3g
故答案为:(1)①水;放;腐蚀;②CO2;滴加盐酸产生气泡;
(2)①8;②3.3;
③设l0片钙片中含碳酸钙的质量为x
CaCO3+2HCl═CaCl2+H2O+CO2↑
100 44
x 3.3g
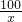 =
=
x=7.5g
每片钙片中含钙的质量= ×
× ×100%=0.3g
×100%=0.3g
答:③l0片钙片中含碳酸钙的质量为7.5g;④每片含钙元素0.3g.
分析:(1)根据氧化钙、氢氧化钙和碳酸钙的性质及变化规律,进行分析与解答;
(2)①由标签中的标明信息,进行计算;
②根据质量守恒定律,由反应前后物质的总质量差,计算产生二氧化碳的质量;
③根据反应的化学方程式,由二氧化碳的质量计算碳酸钙的质量;
④由每片钙片中所含碳酸钙的质量计算其中所含钙的质量.
点评:本题通过对生石灰变质的分析及生活中常见药物钙片的相关计算,考查对常见物质性质及变化规律的掌握及分析与计算的能力.
②氢氧化钙能与二氧化碳发生反应生成碳酸酸钙,向久置的一包生石灰中滴加稀盐酸,若有气体产生则说明已变质生成了碳酸钙,这是利用碳酸钙与盐酸反应放出二氧化碳的变化规律;
(2)①根据标签中所标注:每瓶50片,重40g的信息,可得知10片钙片的总质量=
 ×40g=8g;
×40g=8g;②根据质量守恒定律,10片钙片与盐酸完全反应产生二氧化碳的质量=8g+20g-24.7g=3.3g
故答案为:(1)①水;放;腐蚀;②CO2;滴加盐酸产生气泡;
(2)①8;②3.3;
③设l0片钙片中含碳酸钙的质量为x
CaCO3+2HCl═CaCl2+H2O+CO2↑
100 44
x 3.3g
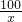 =
=
x=7.5g
每片钙片中含钙的质量=
 ×
× ×100%=0.3g
×100%=0.3g答:③l0片钙片中含碳酸钙的质量为7.5g;④每片含钙元素0.3g.
分析:(1)根据氧化钙、氢氧化钙和碳酸钙的性质及变化规律,进行分析与解答;
(2)①由标签中的标明信息,进行计算;
②根据质量守恒定律,由反应前后物质的总质量差,计算产生二氧化碳的质量;
③根据反应的化学方程式,由二氧化碳的质量计算碳酸钙的质量;
④由每片钙片中所含碳酸钙的质量计算其中所含钙的质量.
点评:本题通过对生石灰变质的分析及生活中常见药物钙片的相关计算,考查对常见物质性质及变化规律的掌握及分析与计算的能力.

练习册系列答案
 综合自测系列答案
综合自测系列答案
相关题目
 有一瓶放置时间较久的钙片.
有一瓶放置时间较久的钙片.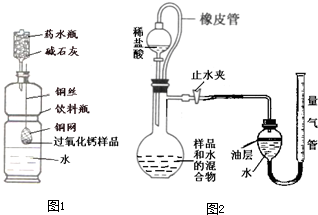 (2011?仪征市一模)长途运输鱼苗时,人们常在水中加入少量过氧化钙(CaO2)固体,为鱼提供氧气,过氧化钙与水反应除生成氧气外,还生成什么物质?课外兴趣小组决定对这一过程中进行探究:
(2011?仪征市一模)长途运输鱼苗时,人们常在水中加入少量过氧化钙(CaO2)固体,为鱼提供氧气,过氧化钙与水反应除生成氧气外,还生成什么物质?课外兴趣小组决定对这一过程中进行探究: