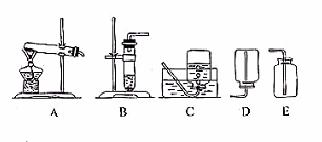
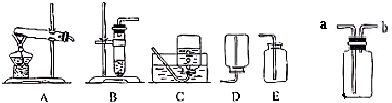
题目内容
有一种气体,可能由氢气、一氧化碳、甲烷和二氧化碳四种气体中的一种或几种组成,为证明该气体的组成,进行了下面三组实验:| 操作步骤 | 实验现象 | ||
| ①将该气体通过澄清的石灰水 | 未见出现浑浊现象 | ||
| ②将该气体点燃,在火焰的上方罩一只冷而干燥的烧杯,烧杯倒转后,注入少量清石灰水,震荡, | 烧杯壁上有水珠出现;发现杯内石灰水变浑浊. | ||
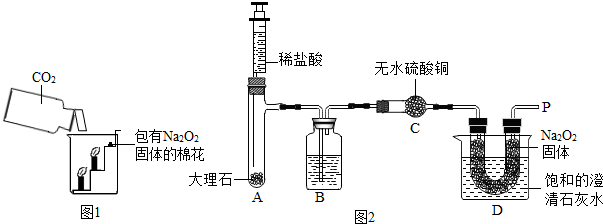
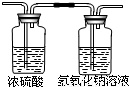
| ③若为进一步确定气体的组成,设计了两种方案.将1.48g该气体完全燃烧,依次通过如右图所示的装置(每步均完全吸收)称量装置前后变化的质量. | 方 案 A | 浓硫酸增重4.68g;氢氧化钠溶液增重3.52g | |
| 方 案 B | 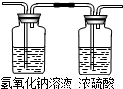 | 氢氧化钠溶液增重8.01g;浓硫酸增重0.30g. | |
(1)写出甲烷燃烧的化学方程式:______ CO2+2H2O
【答案】分析:(1)含C、H元素的可燃烧物完全燃烧生成二氧化碳和水;甲烷由C、H元素组成的最简单的有机物;
(2)二氧化碳能使澄清的石灰水变浑浊,实验室经常使用澄清石灰水检验二氧化碳气体;由化学变化前后元素的种类不变的特点,根据燃烧生成二氧化碳和水,推断气体组成中的元素;
(3)利用二氧化碳能与氢氧化钠反应的性质,可采取氢氧化钠溶液瓶吸收燃烧生成物中的二氧化碳;
(4)两个方案中的不同点就在于产生先通过浓硫酸还是先通过氢氧化钠溶液;浓硫酸只吸收水,对产生中的二氧化碳不产生影响,而氢氧化钠溶液在吸收二氧化碳的同时会影响到产物中的水;
(5)浓硫酸吸水而增重,氢氧化钠溶液吸收二氧化碳而增重,根据增重量可知生成二氧化碳和水的质量;化学变化前后元素的种类和质量都不变.
解答:解:(1)甲烷由C、H元素组成,完全燃烧时生成二氧化碳和水;
故答案为:CH4+2O2 CO2+2H2O;
CO2+2H2O;
(2)混合气体通过澄清石灰水,石灰水没有出现浑浊,说明混合气体中不含二氧化碳;混合气体燃烧后烧杯壁有水出现且出现石灰水变浑浊,说明燃烧后生成水和二氧化碳;则混合气体中一定含有C、H元素;
故答案为:CO2;C、H;
(3)二氧化碳与氢氧化钠反应,生成碳酸钠和水;
故答案为:2NaOH+CO2=Na2CO3+H2O;
(4)如果燃烧后产生先通过氢氧化钠溶液,二氧化碳被吸收的同时,水蒸气通过溶液时遇冷液化,然后再通过浓硫酸,浓硫酸吸收的水则不是燃烧形成的水,实验结果失去探究意义;所以,方案B不可取;
故答案为:方案A;先氢氧化钠溶液溶液,会让部分水也被氢氧化钠溶液冷却吸收,导致水和二氧化碳的质量都不准.
(5)燃烧生成的4.68g水中H元素质量=4.68g×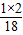 ×100%=0.52g;
×100%=0.52g;
生成的3.52gCO2中C元素质量=3.52g×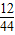 ×100%=0.96g;
×100%=0.96g;
则原混合气体中C、H元素质量和=0.52g+0.96g=1.48g,
与混合气体质量相等,说明混合气体中不含O元素,则混合气体中不含CO;
混合气体中C、H元素质量比=0.96g:0.52g=24:13,而甲烷中C、H元素质量比=12:4=24:8,则混合气体不是纯净的甲烷;
故答案为:CH4、H2.
点评:可燃性气体CH4、H2、CO燃烧时,H2燃烧只生成水,CO燃烧只生成二氧化碳,CH4燃烧既生成水又生成二氧化碳.
(2)二氧化碳能使澄清的石灰水变浑浊,实验室经常使用澄清石灰水检验二氧化碳气体;由化学变化前后元素的种类不变的特点,根据燃烧生成二氧化碳和水,推断气体组成中的元素;
(3)利用二氧化碳能与氢氧化钠反应的性质,可采取氢氧化钠溶液瓶吸收燃烧生成物中的二氧化碳;
(4)两个方案中的不同点就在于产生先通过浓硫酸还是先通过氢氧化钠溶液;浓硫酸只吸收水,对产生中的二氧化碳不产生影响,而氢氧化钠溶液在吸收二氧化碳的同时会影响到产物中的水;
(5)浓硫酸吸水而增重,氢氧化钠溶液吸收二氧化碳而增重,根据增重量可知生成二氧化碳和水的质量;化学变化前后元素的种类和质量都不变.
解答:解:(1)甲烷由C、H元素组成,完全燃烧时生成二氧化碳和水;
故答案为:CH4+2O2
 CO2+2H2O;
CO2+2H2O;(2)混合气体通过澄清石灰水,石灰水没有出现浑浊,说明混合气体中不含二氧化碳;混合气体燃烧后烧杯壁有水出现且出现石灰水变浑浊,说明燃烧后生成水和二氧化碳;则混合气体中一定含有C、H元素;
故答案为:CO2;C、H;
(3)二氧化碳与氢氧化钠反应,生成碳酸钠和水;
故答案为:2NaOH+CO2=Na2CO3+H2O;
(4)如果燃烧后产生先通过氢氧化钠溶液,二氧化碳被吸收的同时,水蒸气通过溶液时遇冷液化,然后再通过浓硫酸,浓硫酸吸收的水则不是燃烧形成的水,实验结果失去探究意义;所以,方案B不可取;
故答案为:方案A;先氢氧化钠溶液溶液,会让部分水也被氢氧化钠溶液冷却吸收,导致水和二氧化碳的质量都不准.
(5)燃烧生成的4.68g水中H元素质量=4.68g×
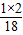 ×100%=0.52g;
×100%=0.52g;生成的3.52gCO2中C元素质量=3.52g×
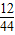 ×100%=0.96g;
×100%=0.96g;则原混合气体中C、H元素质量和=0.52g+0.96g=1.48g,
与混合气体质量相等,说明混合气体中不含O元素,则混合气体中不含CO;
混合气体中C、H元素质量比=0.96g:0.52g=24:13,而甲烷中C、H元素质量比=12:4=24:8,则混合气体不是纯净的甲烷;
故答案为:CH4、H2.
点评:可燃性气体CH4、H2、CO燃烧时,H2燃烧只生成水,CO燃烧只生成二氧化碳,CH4燃烧既生成水又生成二氧化碳.

练习册系列答案
相关题目
水是人类最宝贵的自然资源,多一滴水,就可能多一条生命.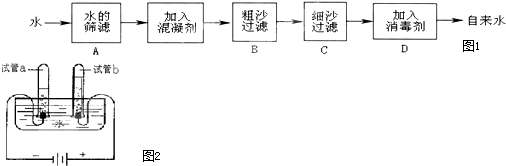
(1)我国规定水质必须在感官性指标、化学指标、病理学指标等方面,达标后方可成为生活饮用水.主要指标的要求为:
a.不得呈现异色 b.不得有异嗅异味 c.水应澄清透明 d.不得含有细菌和病毒
①前两个指标可以利用
②自来水厂生产自来水的过程如图1所示:
由图1可知:净化水时,c、d两个指标可通过图1中的B、C、
(2)为了保护河里的水质,下列做法合理的是(填序号)
A.抑制水中所有动、植物的生长 B.不任意排放工业废水
C.禁止使用农药和化肥 D.生活污水经过净化处理后再排放
(3)列举日常生活中节约用水的两种方法:①
(4)小明利用图2所示的装置探究水的组成.请回答:
①电解水时试管a中产生的气体为
②通电一段时间后,试管a与试管b所收集到的气体体积之比约为
③通过该实验小明得出了许多结论,请你说出一条结论
(5)化肥施用不当是引起水源污染的原因之一,我们必须学会科学施肥的方法.某生产碳酸氢铵(NH4HCO3) 化肥的企业,作了一个如下表所示的大型户外广告.
根据相关信息回答下列问题:
①请你通过计算(写出计算过程)判断该广告是否属于虚假广告:
②经过质量监督部门检测发现该化肥的含氮量为17.5%,则其中NH4HCO3的质量分数为

(1)我国规定水质必须在感官性指标、化学指标、病理学指标等方面,达标后方可成为生活饮用水.主要指标的要求为:
a.不得呈现异色 b.不得有异嗅异味 c.水应澄清透明 d.不得含有细菌和病毒
①前两个指标可以利用
活性炭
活性炭
(填物质名称)的吸附作用而达到.②自来水厂生产自来水的过程如图1所示:
由图1可知:净化水时,c、d两个指标可通过图1中的B、C、
D
D
(填字母序号)而达到.但自来水在饮用前,往往要煮沸,这不仅可以杀菌消毒,还可以降低水的硬度
降低水的硬度
.(2)为了保护河里的水质,下列做法合理的是(填序号)
BD
BD
.A.抑制水中所有动、植物的生长 B.不任意排放工业废水
C.禁止使用农药和化肥 D.生活污水经过净化处理后再排放
(3)列举日常生活中节约用水的两种方法:①
一水多用
一水多用
;②随手关闭水笼头
随手关闭水笼头
.(4)小明利用图2所示的装置探究水的组成.请回答:
①电解水时试管a中产生的气体为
氢气
氢气
.②通电一段时间后,试管a与试管b所收集到的气体体积之比约为
2:1
2:1
,用化学式表示该实验的化学反应2H2O
2H2↑+O2↑
| ||
2H2O
2H2↑+O2↑
.
| ||
③通过该实验小明得出了许多结论,请你说出一条结论
水由氢、氧两种元素组成
水由氢、氧两种元素组成
.(5)化肥施用不当是引起水源污染的原因之一,我们必须学会科学施肥的方法.某生产碳酸氢铵(NH4HCO3) 化肥的企业,作了一个如下表所示的大型户外广告.
根据相关信息回答下列问题:
①请你通过计算(写出计算过程)判断该广告是否属于虚假广告:
②经过质量监督部门检测发现该化肥的含氮量为17.5%,则其中NH4HCO3的质量分数为
98.87%
98.87%
.| 宇宙牌化肥--国际首创 主要成分:碳酸氢铵(NH4HCO3) 含氮量居全球化肥之首:24% 净含量:50kg/袋 “宇宙”化肥有限责任公司出品 今天又是化学实验室开放日,老师拿出两瓶无标签的试剂,分别是固体和液体,他取少量试剂在试管中混合,立即产生一种无色气体.我们对此气体展开了一系列探究: |
| 猜想 | 实验步骤 | 现象及结论 |
| 此气体可能是______ |

产生此气体的化学方程式可能是______.
②我想制取该气体,采用的发生装置可选取图1中的______(填序号).收集装置是______.
③如用图2装置收集该气体,气体由______端(填“a”或“b”)导入.
(2)我猜想此无色气体还可能是另外一种气体,可以产生它的化学方程式是______.
(3)硫化氢是一种无色且有臭鸡蛋气味的气体,能溶于水,可形成一种酸溶液--氢硫酸.实验室用硫化亚铁跟稀硫酸反应制取硫化氢气体.试回答:
①硫化氢气体具有臭鸡蛋气味,这是硫化氢的______(填“物理”或“化学”)性质.
②硫化氢的水溶液能使石蕊试液变______色.
③实验室制取H2S气体时,发生装置应选用______,收集装置应选用______(填仪器编号).
今天又是化学实验室开放日,老师拿出两瓶无标签的试剂,分别是固体和液体,他取少量试剂在试管中混合,立即产生一种无色气体。我们对此气体展开了一系列探究:
(1)①此气体是什么气体?验证它的实验方案如下 :
| 猜想 | 实验步骤 | 现象及结论 |
| 此气体可能是_________ |
产生此气体的化学方程式可能是______________________________________。
②我想制取该气体,采用的发生装置可选取右图中的_________(填序号)。收集装置是__________。
③如用左图装置收集该气体,气体由_______端(填“a”或“b”)导入。
(2)我猜想此无色气体还可能是另外一种气体,可以产生它的化学方程式是_____________________________________________。
(3)、硫化氢是一种无色且有臭鸡蛋气味的气体,能溶于水,可形成一种酸溶液——氢硫酸。实验室用硫化亚铁跟稀硫酸反应制取硫化氢气体。试回答:
①硫化氢气体具有臭鸡蛋气味,这是硫化氢的___________(填“物理”或“化学”)性质。
②硫化氢的水溶液能使石蕊试液变_________色。
 ③实验室制取H2S气体时,发生装置应选用_____,收集装置应选用_________(填仪器编号)。
③实验室制取H2S气体时,发生装置应选用_____,收集装置应选用_________(填仪器编号)。