题目内容
【题目】进入冬季,雾霾天气频繁出现。雾是空气中水蒸气凝结的微小水滴大量悬浮在近地面空气中形 成的;霾形成的主要原因是工业燃煤、车用燃料不充分燃烧产生的炭粒、碳氢化合物以及建筑尘埃 等大量混入空气形成的。二者结合形成雾霾。化学兴趣小组的同学们收集了空气净化器滤芯上的少 量黑色物质,对其成分进行了探究。
(提出问题)空气净化器滤芯上的黑色物质中是否含有炭粒和水?
(查阅资料)
A 碳氢化合物具有可燃性,燃烧生成水和二氧化碳。B 无水硫酸铜为白色固体,遇水会变蓝。
(进行实验)
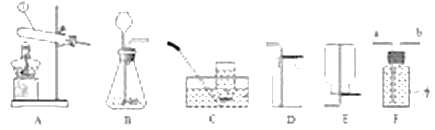
同学们在老师的指导下对其进行探究,下图为探究过程中的部分装置。加热前先向装置 A 中通入足量氧气,排尽空气。这样做的目的是①_________。

实验操作 | 实验现象 | 实验结论 |
点燃酒精灯,充分反应 | ②________ | 黑色物质中含有炭粒和水 |
(反思与评价)张同学认为该结论不严谨,他的理由是③_________。
(交流与讨论)连接装置的正确顺序如上图所示。若将装置 B、C 的位置对调,会对实验结果产生的影响是④_________。
(拓展延伸)雾霾的成分非常复杂,通过以上实验只能证明黑色物质中含有碳元素和氢元素,若要了解雾霾的成分,需进一步的学习和研究。同学们在 网上查阅资料还发现了一种防雾霾口罩(如图),已知某品牌 KN95 型防颗粒物口罩使用了无纺布、活性炭等材料,其中无纺布和活性炭对颗粒物 和有害气体能分别起到⑤_________作用。

【答案】避免空气中的水蒸气和二氧化碳对实验现象产生干扰 B中白色固体变蓝,C中澄清石灰水变浑浊; 碳氢化合物燃烧后也会生成水和二氧化碳 干扰对水蒸气的检验 过滤,吸附
【解析】
①加热前先向装置 A 中通入足量氧气,排尽空气的目的是:避免空气中的水蒸气和二氧化碳对实验现象产生干扰,故填:避免空气中的水蒸气和二氧化碳对实验现象产生干扰;
②实验结论是黑色物质中含有炭粒和水,则现象应为:B中白色固体变蓝,C中澄清石灰水变浑浊;故填:B中白色固体变蓝,C中澄清石灰水变浑浊;
③由资料可知:碳氢化合物具有可燃性,燃烧生成水和二氧化碳,故实验结论不严谨,故填:碳氢化合物燃烧后也会生成水和二氧化碳。
④澄清石灰水中含有水,若BC对调,则会干扰对水蒸气的检验,故填:干扰对水蒸气的检验;
⑤无纺布可以起到过滤作用,活性炭因其疏松多孔的结构具有吸附性,故填:过滤,吸附;

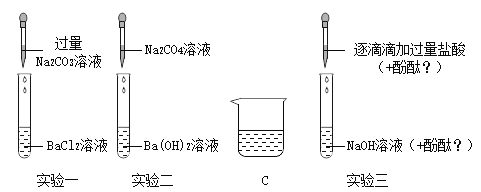
【题目】化学兴趣小组的同学在探究碱溶液的化学性质时,进行了下图所示的实验。
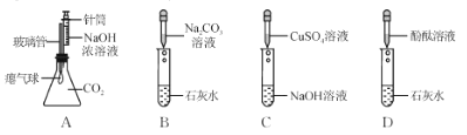
(1)实验 A 中,推入 NaOH溶液后,可观察到的现象是____。
(2)实验B 中发生反应的化学方程式为______。
实验结束后,小组同学对B 试管中上层清液的溶质成分产生疑问,作出猜想:
猜想一:只含有 NaOH;猜想二:含有 NaOH、Na2CO3;猜想三:含有 NaOH、Ca(OH)2。同学们取少量B 试管中的清液分别置于甲、乙两支试管中,进行探究:
实验操作 | 实验现象 | 结论 |
在试管甲中滴加碳酸钠溶液 | 不产生白色沉淀 | 猜想三错误 |
在试管乙中滴加足量稀盐酸 | ______ | 猜想二正确 |
(3)A、B、C、D 四个实验中能体现碱化学通性的是 ____(填字母)。小组同学经过 讨论认为 A、B、C、D 四个实验并没有探究出碱所有的化学通性。从这四个实验中选择一个,继续加入相关试剂,能得出碱的其它化学通性。实验的方案是___________(写出操作和现象)。
【题目】铜及铜的化合物在生产、生活中有着广泛的应用。
(一)铜的广泛应用
(1)我国在西汉时期就有“曾青得铁则化为铜”之说,用化学方程式表示其原理______。
(2)铜在工业上可用于生产电缆(外面包裹了电缆皮),这是利用了铜的_____性。
(二)硫酸铜晶体的制备
工业上用含铜废料(如:碎铜、电缆皮等)。某化学小组的同学提出可以用含铜废料制备硫酸铜晶体(CuSO4·xH2O).主要流程如下:
![]()
(1)含铜废料粉碎的目的是__________。
(2)该流程中,加入H2O2后要求温度控制在50℃到60℃加热的原因为_____。
(3)兴趣小组同学一致指出,将滤液经蒸发浓缩、_____(填结晶方法)、过滤等操作后,用少量95%的酒精淋洗后晾干,得硫酸铜晶体(CuSO4·xH2O),晶体采用酒精淋洗而不用水的原因是____________。
(三)铜生锈会生成碱式碳酸铜,而工业上所制得的碱式碳酸铜种类较多,其组成表示为:xCuCO3·yCu(OH)2·zH2O。
资料:xCuCO3·yCu(OH)2·zH2O加热至200时会分解得到氧化铜,二氧化碳和水。
测定某种产品的组成,该兴趣小组准确称量了25.8g的样品,设计了如下装置并进行实验:
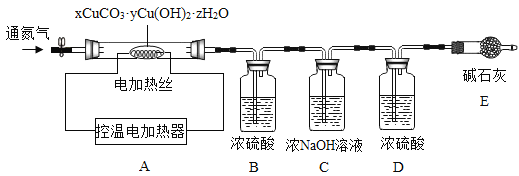
实验数据记录如下表:
B中溶液质量/g | C中溶液质量/g | D中溶液质量/g | E中固体质量/g | |
反应前 | 100.0 | 100.0 | 100.0 | 120.5 |
反应后 | 105.4 | 104.4 | 100.2 | 120.5 |
实验分析和数据处理
(1)实验前应该先_________,再鼓入一段时间氮气后称量B、C、D、E的质量。
(2)停止鼓入氮气,调控温电加热220℃持续加热,观察到装置B中______时表明碱式碳酸铜已经完全分解。
(3)反应结束后,再缓缓鼓入一段时间氮气的目的是___________。
(4)该碱式碳酸铜的化学式是__________。
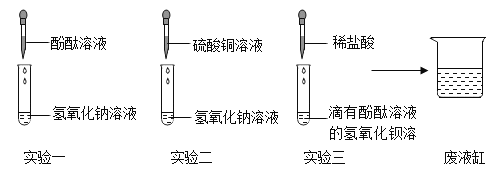
【题目】同学们用碳酸钠溶液和盐酸的反应验证质量守恒定律,实验后他们对残留废液的成分进行探究。
(推理假设)
上述两种物质发生反应的化学方程式为__________,由此推测出废液中一定有NaCl,可能有___________。
(实验探究)
(1)确定废液中是否含有盐酸:
①选择试剂:根据盐酸的化学性质,同学们选用了如图所示的五种物质,其中物质X是酸碱指示剂中的_________溶液。
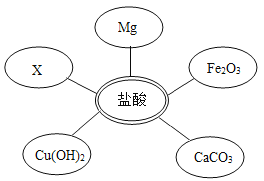
②实验验证:某同学向废液中加入少量的镁粉,观察到______________,确定废液中一定没有盐酸。
(2)确定废液中是否含有Na2CO3:某同学选用_________测出废液的pH=l0,确定废液中一定含有Na2CO3。
(3)处理废液,回收利用:欲从废液中得到纯净的NaCl,请完成如下实验方案设计。
方案 | 加入试剂 | 提纯的方法 | 方案评价 |
一 | 适量Ca(NO3)2溶液 | 过滤、蒸发结晶 | _______(选填可行或不可行) |
二 | 稍过量的________ | ________ | 可行 |
(4)拓展运用:
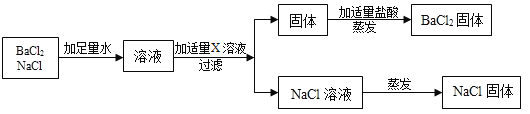
按如下图方案分离BaCl2和NaCl的固体混合物时,X溶液中溶质是___________。