题目内容
取含铁、氧两种元素的固体样品11.6g,通入足量CO并充分加热,将产生的气体通入足量澄清石灰水,充分反应后,得沉淀20.0g.该固体的组成不可能是( )
| A、Fe2O3 | B、Fe3O4 | C、Fe和Fe2O3 | D、FeO和Fe2O3 |
练习册系列答案
相关题目
下列应用和相应的原理(用化学方程式表示)及基本反应类型都正确的是( )
A、铁丝在空气中燃烧 3Fe+2O2
| ||||
| B、用稀硫酸洗去附着在试管壁上的铜 Cu+H2SO4═CuSO4+H2↑ 置换反应 | ||||
| C、久置在空气中的石灰水表面有白膜 CO2+Ca(OH)2=CaCO3↓+H2O 复分解反应 | ||||
D、通电使水分解 2H2O
|
下列设计方案可行,且化学方程式书写正确的是( )
| A、用Al(OH)3治疗胃酸过多症:Al(OH)3+3HCl═AlCl3+3H2O | ||||
| B、实验室用稀硫酸与铜片反应制取H2:Cu+H2SO4═CuSO4+H2↑ | ||||
| C、用铁粉从含硝酸银的废水中提取金属银:Fe+3AgNO3═Fe(NO3)3+3Ag | ||||
D、用点燃的方法除去二氧化碳气体中混有的少量一氧化碳:2CO+O2
|
一包混有杂质的Na2CO3,其杂质可能是Ca(NO3)2、KCl、NaHCO3,今取10.6g样品,溶于水得澄清溶液,加入足量的盐酸,收集到4g CO2,则下列判断正确的是( )
| A、样品中只含有NaHCO3 | B、样品中一定混有NaHCO3,可能有KCl | C、样品中有NaHCO3,也有Ca(NO3)2 | D、样品中混有KCl,也可能有NaHCO3 |
现有生石灰和碳酸钙的固体混合物9.5g,将其高温煅烧一段时间后,剩余固体8.4g,向剩余固体中加入150g溶质质量分数为7.3%的稀盐酸至恰好不再产生气泡为止,所得溶液恰好为中性,则原固体混合物中钙元素的质量分数约为( )
| A、50% | B、63.2% | C、84.5% | D、40% |
工业上可以用金属锌与稀硫酸反应制备硫酸锌.现有20g部分被氧化的金属锌,测得其中氧元素的含量为16%,加入一定量的稀硫酸后,恰好完全反应.则生成的硫酸锌的质量为( )
| A、16.8g | B、40.25g | C、16.1g | D、24g |
某氧化钙和碳酸钙的固体混合物中钙元素的质量分数为50%,将其高温煅烧至碳酸钙完全分解,称得剩余固体的质量为84g.则生成CO2的质量为( )
| A、66 g | B、36 g | C、37g | D、120 g |
学习化学的目的关不在于人人都要成为化学家,更重要的是学会用化学知识去解决生产生活中的问题,下列做法中错误的是( )
| A、用活性炭制品清除异味 | B、油库着火,用水扑灭 | C、用含有适量氢氧化钠的清洁剂去除炉具上的油污 | D、用稀盐酸鉴别黄金制品和假黄金(铜锌合金)制品 |
下列图象能正确反映其对应操作中各量变化关系的是( )
A、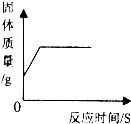 将碳和氧化铜混合在高温下反应 | B、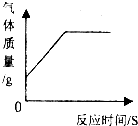 用一定质量的高锰酸钾加热制氧气 | C、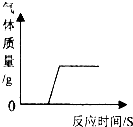 向一定质量的石灰石中加入过量的稀盐酸 | D、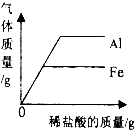 分别向等质量的铝和铁中加入溶质质量分数相同的稀盐酸至过量 |
