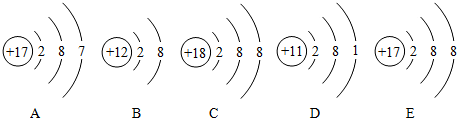
题目内容
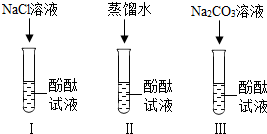 张宁和刘明同学学习完酸、碱、盐后发现:碱溶液能使酚酞溶液变红,Na2CO3溶液也能使酚酞溶液变红.通过学习知道,碱溶液使酚酞溶液变红,是因为碱在水中离解出OH-,那么Na2CO3溶液中究竟是哪种粒子使酚酞溶液变红呢?请你帮助他俩完成实验探究.
张宁和刘明同学学习完酸、碱、盐后发现:碱溶液能使酚酞溶液变红,Na2CO3溶液也能使酚酞溶液变红.通过学习知道,碱溶液使酚酞溶液变红,是因为碱在水中离解出OH-,那么Na2CO3溶液中究竟是哪种粒子使酚酞溶液变红呢?请你帮助他俩完成实验探究.【提出问题】Na2CO3属于
【进行猜想】
(1)Na+使酚酞溶液变红.
(2)水分子使酚酞溶液变红.
(3)
【设计实验】
(1)实验Ⅰ的目的是为了验证猜想
(2)刘明同学认为实验Ⅱ没必要做,他的理由是
(3)实验Ⅲ滴入Na2CO3溶液,振荡,酚酞试液变红.向变红后的溶液中滴加CaCl2溶液至过量,振荡,
出现的现象是
(4)由实验Ⅰ、Ⅱ、Ⅲ得出猜想(3)正确.
张宁对此结论有些质疑,于是他查阅资料.
【查阅资料】Na2CO3溶液中,CO32-和H2O发生如下反应:CO32-+H2O═HCO-3+OH-
【得出结论】Na2CO3溶液中使酚酞溶液变红的粒子是
考点:实验探究物质的性质或变化规律,盐的化学性质,书写化学方程式、文字表达式、电离方程式
专题:科学探究
分析:【提出问题】电离出金属离子和酸根离子的化合物是盐;
【进行猜想】根据碳酸钠溶液中存在的离子分析;
【设计实验】
(1)氯化钠中含有钠离子,可以探究钠离子能否使酚酞变色;
(2)氯化钠溶液中含有大量水分子,所以实验Ⅱ没有必要做;
(3)主要从碳酸钠溶液和氯化钙溶液的反应可以得出,碳酸根离子减少,使红色逐渐消失;碳酸钠和氯化钙反应生成碳酸钙和氯化钠;
(4)氢氧根离子能够使酚酞变红,所以可以判断在碳酸钠溶液中存在氢氧根离子.
【进行猜想】根据碳酸钠溶液中存在的离子分析;
【设计实验】
(1)氯化钠中含有钠离子,可以探究钠离子能否使酚酞变色;
(2)氯化钠溶液中含有大量水分子,所以实验Ⅱ没有必要做;
(3)主要从碳酸钠溶液和氯化钙溶液的反应可以得出,碳酸根离子减少,使红色逐渐消失;碳酸钠和氯化钙反应生成碳酸钙和氯化钠;
(4)氢氧根离子能够使酚酞变红,所以可以判断在碳酸钠溶液中存在氢氧根离子.
解答:解:【提出问题】碳酸钠能电离出钠离子和碳酸根离子,所以属于盐;
【进行猜想】碳酸钠溶液中存在钠离子、碳酸根离子、水分子;
【设计实验】
(1)向氯化钠溶液中加酚酞不变色,说明氯化钠溶液中的粒子都不能使酚酞变红;
(2)氯化钠溶液中含有大量水分子,在实验(1)中得到验证,所以实验(2)的探究是多余的;
(3)碳酸钠溶液和氯化钙溶液反应生成碳酸钙沉淀,所以现象为红色逐渐消失,产生白色沉淀;化学方程式为:Na2CO3+CaCl2═CaCO3↓+2NaCl;
(4)我们知道只有氢氧根离子才能使酚酞变红,所以由碳酸钠溶液能使酚酞溶液变红,可以判断溶液中存在氢氧根离子;
故答案为:【提出问题】盐;
【进行猜想】CO32-
【设计实验】
(1)探究Na+是否能使酚酞试液变红;
(2)酚酞试液中就有水分子(或氯化钠溶液中含有水分子);
(3)白色沉淀; Na2CO3+CaCl2═CaCO3↓+2NaCl;
(4)OH-.
【进行猜想】碳酸钠溶液中存在钠离子、碳酸根离子、水分子;
【设计实验】
(1)向氯化钠溶液中加酚酞不变色,说明氯化钠溶液中的粒子都不能使酚酞变红;
(2)氯化钠溶液中含有大量水分子,在实验(1)中得到验证,所以实验(2)的探究是多余的;
(3)碳酸钠溶液和氯化钙溶液反应生成碳酸钙沉淀,所以现象为红色逐渐消失,产生白色沉淀;化学方程式为:Na2CO3+CaCl2═CaCO3↓+2NaCl;
(4)我们知道只有氢氧根离子才能使酚酞变红,所以由碳酸钠溶液能使酚酞溶液变红,可以判断溶液中存在氢氧根离子;
故答案为:【提出问题】盐;
【进行猜想】CO32-
【设计实验】
(1)探究Na+是否能使酚酞试液变红;
(2)酚酞试液中就有水分子(或氯化钠溶液中含有水分子);
(3)白色沉淀; Na2CO3+CaCl2═CaCO3↓+2NaCl;
(4)OH-.
点评:本题考查了学生对所提供信息进行处理和利用微粒性质的差异进行实验设计的能力,要求较高.

练习册系列答案
相关题目
下列各种溶液混合时,能产生红褐色沉淀的是( )
| A、FeCl3和KOH |
| B、Mg(NO3)2和NaOH |
| C、NaCl和CuSO4 |
| D、K2CO3和Ba(OH)2 |
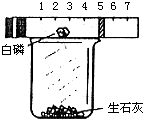 某同学用图所示的装置粗略地测定空气中氧气的体积分数.图中烧杯上方玻璃管(预先固定好)中部有一可左右滑动的活塞,活塞左端管内密封有空气,活塞右端的玻璃管口跟空气连通,实验开始前活塞处在刻度5cm处.(提示:向烧杯内加入适量水,与生石灰反应放出大量的热点燃白磷.)
某同学用图所示的装置粗略地测定空气中氧气的体积分数.图中烧杯上方玻璃管(预先固定好)中部有一可左右滑动的活塞,活塞左端管内密封有空气,活塞右端的玻璃管口跟空气连通,实验开始前活塞处在刻度5cm处.(提示:向烧杯内加入适量水,与生石灰反应放出大量的热点燃白磷.)